J Microsc Ultrastruct. 2017 Oct-Dec; 5(4): 167–176. Published online 2017 Aug 2. doi: 10.1016/j.jmau.2017.07.003
Elfide Gizem Kıvrak , * Kıymet Kübra Yurt , Arife Ahsen Kaplan , Işınsu Alkan , i Gamze Altun
Department of Histology and Embryology, Faculty of Medicine, Ondokuz Mayıs University, Samsun, Turkey*
Corresponding author at: Department of Histology and Embryology, Faculty of Medicine, Ondokuz Mayis University, 55139, Samsun, Turkey.
E-mail address: moc.liamg@mzg.edifle (E.G. Kıvrak).
Skrót
Urządzenia technologiczne stały się niezbędnymi elementami codziennego życia.
Jednak ich szkodliwy wpływ na organizm, zwłaszcza na układ nerwowy, jest też dobrze znany.
Pola elektromagnetyczne (EMF) mają różne skutki chemiczne - w tym powodują degradację dużych cząsteczek w komórkach i zaburzają równowagę jonową.
Mimo że cząsteczki tlenu są niezbędne do życia, podczas reakcji biologicznych mogą powodować powstawanie niebezpiecznych produktów ubocznych, zwanych reaktywnymi formami tlenu (RFT).
Te reaktywne formy tlenu mogą uszkadzać komponenty komórkowe, takie jak białka, lipidy i DNA.
Istnieją systemy obrony przeciwutleniającej, które mają na celu kontrolowanie powstawania wolnych rodników i zapobieganie ich szkodliwemu wpływowi na system biologiczny.
Tworzenie się wolnych rodników może zachodzić na różne sposoby, w tym za pomocą światła ultrafioletowego, leków, utleniania lipidów, reakcji immunologicznych, promieniowania, stresu, palenia, alkoholu i biochemicznych reakcji redoks.
Stres oksydacyjny występuje, gdy system obrony przeciwutleniającej nie jest w stanie zapobiec szkodliwemu działaniu wolnych rodników.
Kilka badań wykazało, że ekspozycja na pola elektromagnetyczne powoduje stres oksydacyjny w wielu tkankach organizmu.
Wiadomo, że ekspozycja na EMF zwiększa stężenie wolnych rodników i identyfikowalność oraz może wpływać na rekombinację par rodników.
Celem tego przeglądu było podkreślenie wpływu stresu oksydacyjnego na układy przeciwutleniające.
1. Wstęp
Pola elektromagnetyczne (EMF) są emitowane przez wiele naturalnych i wytworzonych przez człowieka źródeł, które odgrywają ważną rolę w życiu codziennym.
Ponad 3 miliardy ludzi na całym świecie jest codziennie narażonych na działanie pól elektromagnetycznych [ 1 ].
Długotrwałe narażenie na pola elektromagnetyczne staje się przedmiotem znaczących badań naukowych, ponieważ może powodować istotne zmiany i szkodliwe skutki w układach biologicznych.
Biologiczne skutki pola elektromagnetycznego można podzielić na termiczne i nietermiczne.
Efekty termiczne są związane z ciepłem wytwarzanym przez pola elektromagnetyczne w określonym obszarze.
Mechanizm ten zachodzi poprzez zmianę temperatury wynikającą z pól o częstotliwości radiowej (RF).
Możliwe, że każda interakcja między polami RF a żywymi tkankami powoduje transfer energii, co powoduje wzrost temperatury.
Skóra i inne tkanki powierzchniowe zwykle pochłaniają promieniowanie nietermiczne emitowane przez telefony komórkowe;
powoduje to nieznaczny
wzrost temperatury mózgu lub innych narządów organizmu [ 2 ].
Mechanizmy nietermiczne to takie, które nie są bezpośrednio związane z tą zmianą temperatury, ale raczej z niektórymi innymi zmianami w tkankach w związku z ilością pochłanianej energii [ 3 , 4 ].
Badania wpływu energii RF z systemów komunikacyjnych na zdrowie wykazały, że należy również omówić skutki nietermiczne.
Fakt, że możliwe biofizyczne mechanizmy interakcji RF-EMF z żywymi komórkami nie zostały jeszcze w pełni wyjaśnione, jest jednym z powodów tych dyskusji [ 4 ].
Znaczna część wielu badań dotyczących pola elektromagnetycznego dotyczyła „nietermicznego” wpływu RF na tkanki biologiczne [ 5 , 6 ].
Zaobserwowano, że w efekcie tym pośredniczy wytwarzanie reaktywnych form tlenu (RFT) [ 7 ].
RFT biorą udział w różnych funkcjach komórkowych.
Mogą być niezbędne - lub bardzo toksyczne dla homeostazy komórkowej [ 8 ].
Ich działanie cytotoksyczne wynika z peroksydacji fosfolipidów błonowych.
Powoduje to zmianę przewodnictwa membrany i utratę integralności membrany [ 9 ].
Zaobserwowano, że ekspozycja na EMF powoduje zwiększoną produkcję wolnych rodników w środowisku komórkowym.
Organizmy żywe mają mechanizmy przeciwutleniające, takie jak glutation (GSH), peroksydaza glutationowa (GPx), katalaza (CAT) i dysmutaza ponadtlenkowa (SOD), w celu złagodzenia uszkodzeń powodowanych przez ROS i ich produkty [ 10 ].
Ten mechanizm obronny działa poprzez tłumienie - lub osłabianie reakcji łańcuchowej wyzwalanej przez RFT.
W tym przypadku mechanizmy obronne antyoksydantów są osłabiane przez działanie czynnika powodującego nadprodukcję RFT, w tym pola elektromagnetycznego, powodując tym samym stres oksydacyjny [ 11 , 12 ].
Badania z ostatnich lat wykazały, że wolne rodniki odgrywają główną rolę w mechanizmie wielu chorób, takich jak cukrzyca czy nowotwory [ 13 , 14 , 15 ].
Jednak w tej kwestii nadal istnieje wiele niepewności i kilka pytań pozostaje jeszcze odpowiedź.
W przeglądzie oceniano wpływ ekspozycji na pola elektromagnetyczne na tkanki biologiczne, koncentrując się na kilku zmianach aktywności enzymów przeciwutleniających i różnych parametrach utleniania.
2. Efekty pola elektromagnetycznego
Szerokie spektrum fal elektromagnetycznych jest obecnie emitowane przez radary, sprzęt komunikacyjny, stacje bazowe telefonów komórkowych, linie wysokiego napięcia, nadajniki radiowe i telewizyjne, podstacje i sprzęt elektryczny w domu i pracy, a także wiele systemów elektrycznych w środowisku [ 16 ].
Globalny system łączności mobilnej (GSM, 850–900 MHz i 1850–1990 MHz) jest obecnie najbardziej rozbudowanym systemem telekomunikacji mobilnej na świecie [ 17 , 18 ].
(Praca naukowa z czasów - gdy dominowały łącza 2G)
Obecnie używane modele telefonów komórkowych (1800–2200 MHz), laptopy (1000–3600 MHz) i sieci bezprzewodowe działają z promieniowaniem mikrofalowym o wysokiej częstotliwości (2,45 GHz) [ 19 ].
Równolegle do rozwoju technologicznego w tym stuleciu, urządzenia technologiczne stają się coraz ważniejsze w życiu codziennym.
Jednak
pomimo tego, że ułatwiają życie, mogą również powodować szereg problemów zdrowotnych.
W szczególności średni wiek rozpoczynania korzystania z telefonów komórkowych gwałtownie spadł do wieku szkoły podstawowej, a także wydłużają się okresy narażenia na działanie pól elektromagnetycznych.
Jedno z badań wykazało, że już bardzo niska ekspozycja na EMF z telefonów komórkowych może powodować problemy zdrowotne [ 20 ].
W kilku badaniach odnotowano takie wyniki, jak stres, ból głowy, zmęczenie, niepokój, obniżony potencjał uczenia się, upośledzenie funkcji poznawczych i słaba koncentracja w przypadku ekspozycji na promieniowanie mikrofalowe emitowane z telefonów komórkowych [ 2 , 21 , 22 ].
Pola elektromagnetyczne wpływają na procesy metaboliczne w organizmie człowieka i wywierają różne skutki biologiczne na komórki poprzez szereg mechanizmów.
EMF zaburza struktury chemiczne tkanki, ponieważ wysoki stopień absorpcji energii elektromagnetycznej może zmienić prąd elektryczny w organizmie [ 23 ].
W wyniku tego narażenia wpływa na funkcje narządów.
Pola elektryczne wywierają siłę oscylacyjną na każdy wolny jon po obu stronach błony plazmatycznej i powodują, że przechodzą przez nią.
Ten ruch jonów powoduje pogorszenie kanałów jonowych na błonie, zmiany biochemiczne w błonie iw konsekwencji upośledzenie wszystkich funkcji komórkowych [ 24 ].
Ekspozycja na pola elektromagnetyczne może uszkadzać tkanki biologiczne, wywołując zmiany, które można wyjaśnić mechanizmami termicznymi lub nietermicznymi [ 25 ].
Efekty termiczne mogą wystąpić podczas konwersji i pochłaniania ciepła przez energię elektromagnetyczną organizmu.
Podwyższona temperatura ciała jest stabilizowana i łagodzona przez krążenie krwi.
Chociaż efekty nietermiczne nie podnoszą temperatury ciała w stopniu wystarczającym do osłabienia struktury tkanek, ich skutki nadal można postrzegać jako
wzrost produkcji wolnych rodników w tkankach [ 3 ].
Podaje się, że pola elektromagnetyczne, bez względu na to, gdzie występują w widmie częstotliwości, powodują
wzrost poziomu wolnych rodników tlenowych w doświadczalnym środowisku roślin i ludzi [ 26 ].
3. Stres oksydacyjny związany z polem elektromagnetycznym i jego wpływ na tkanki
Wolne rodniki to reaktywne cząsteczki wytwarzane podczas przekształcania żywności w energię przez tlen.
Tworzenie wolnych rodników jest reakcją utleniania zachodzącą na bazie tlenu. [ 27 ].
Ponieważ tlen jest niezbędny do przeżycia, nie można uniknąć powstawania wolnych rodników.
Jednak czynniki dodatkowe, - w tym promieniowanie jonizujące i niejonizujące, zmieniają transkrypcję i translację genów, takich jak JUN, HSP 70 i MYC, poprzez receptor naskórkowego czynnika wzrostu EGFR-ras, prowadząc do powstania RFT [ 28 , 29 ] i powodując nadprodukcja RFT w tkankach [ 30 ].
Reakcja Fentona to proces katalityczny, który przekształca nadtlenek wodoru, produkt mitochondrialnego oddychania oksydacyjnego, w wysoce toksyczny wolny rodnik hydroksylowy.
Niektóre badania sugerują, że EMF jest innym mechanizmem poprzez reakcję Fentona - co sugeruje, że promuje aktywność wolnych rodników w komórkach [ 31 , 32 ].
Chociaż niektórzy badacze donoszą, że RFT pełnią korzystną funkcję, wysoki stopień produkcji RFT może powodować uszkodzenia komórek, powodując szereg chorób.
Te rodniki reagują z różnymi biomolekułami, w tym z DNA (Ryc.1).
Mianowicie energia wolnych rodników nie wystarcza i z tego powodu zachowują się jak złodzieje, którzy odbierają energię innym komórkom i okradają człowieka dla zadowolenia [ 33 ].
Wiele badań sugeruje, że EMF może wyzwalać tworzenie reaktywnych form tlenu w eksponowanych komórkach in vitro [ 34 , 35 , 36 , 37 ] i in vivo [ 7 , 31 , 38 ].
Początkowy etap produkcji RFT w obecności RF jest kontrolowany przez enzym oksydazę NADPH znajdujący się w błonie komórkowej.
W konsekwencji ROS aktywują metaloproteazy macierzy, inicjując w ten sposób wewnątrzkomórkowe kaskady sygnalizacyjne, ostrzegające jądro o obecności zewnętrznej stymulacji.
Te zmiany w transkrypcji i ekspresji białek obserwuje się po ekspozycji na RF [ 39 ].
Kazemi i współpracownicy zbadali wpływ ekspozycji 900 MHz na indukcję stresu oksydacyjnego i poziom wewnątrzkomórkowych RFT w ludzkich komórkach jednojądrzastych.
Nadmierny wzrost poziomu RFT jest ważną przyczyną uszkodzeń oksydacyjnych lipidów i białek oraz kwasów nukleinowych.
W związku z tym powoduje zmiany w aktywności enzymatycznej i ekspresji genów,
prowadząc ostatecznie do różnych chorób, w tym zaburzeń snu, artroskopii, utraty apetytu, cukrzycy, zawrotów głowy, reumatoidalnego zapalenia stawów, chorób układu krążenia, nudności i udaru mózgu [ 40 , 41 , 42 ].
Ponadto degradacja równowagi prooksydacyjno-przeciwutleniającej spowodowana niekontrolowanym wzrostem RFT może również powodować peroksydację lipidów.
Peroksydacja lipidów to proces, w którym błony komórkowe ulegają szybkiemu zniszczeniu w wyniku utleniania składników fosfolipidów zawierających nienasycone kwasy tłuszczowe.
Kontynuując tę reakcję, nadtlenki lipidów (-C0, H) gromadzą się w błonie i przekształcają wielonienasycone kwasy tłuszczowe w substancje biologicznie czynne [ 43 ].
W konsekwencji peroksydacja lipidów prowadzi do znacznych uszkodzeń w komórkach, takich jak zaburzenia transportu błonowego, zmiany strukturalne, płynność błony komórkowej, uszkodzenie receptorów białkowych w strukturach błonowych oraz zmiany w aktywności enzymów błony komórkowej [ 44 ].
Hoyto i współpracownicy wykazali istotną indukcję peroksydacji lipidów po ekspozycji na EMF w mysich komórkach SH-SY5Y i komórkach fibroblastów L929 [ 45 ].
Badania epidemiologiczne sugerują również, że oksydacyjne uszkodzenie lipidów w ścianach naczyń krwionośnych może być istotnym czynnikiem przyczyniającym się do rozwoju miażdżycy [ 46 , 47 , 48 ].
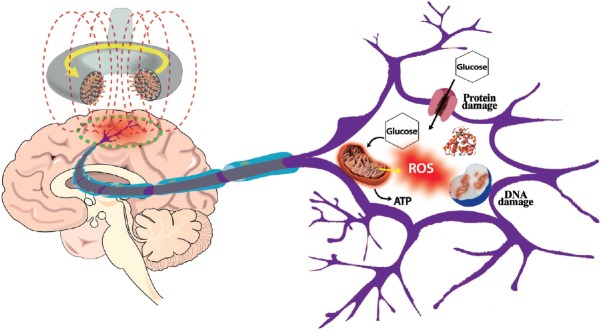
Ryc 1 Reaktywne formy tlenu powstające w wyniku ekspozycji na pola elektromagnetyczne mogą uszkadzać różne struktury komórkowe w neuronach ośrodkowego układu nerwowego [ 49 ].
Badania zwykle koncentrują się na mózgu, ponieważ
podczas użytkowania telefony komórkowe są trzymane blisko głowy.
Istnieje wiele dowodów na to, że EMF może wpływać na funkcje nerwowe w ludzkim mózgu [ 50 ].
Związek między polem elektromagnetycznym a zaburzeniami neurologicznymi można wyjaśnić za pomocą odpowiedzi na szok cieplny [ 51 ].
Reakcja białka w wyniku szoku cieplnego (HSP) dotyczy ogólnie szoku cieplnego, narażenia na metale ciężkie i wpływów środowiskowych, takich jak pola elektromagnetyczne.
Ogólnie HSP jest markerem w komórkach poddanych stresowi.
Żywe organizmy wytwarzają białka stresu, aby przetrwać stresory środowiskowe.
Odpowiedź na szok cieplny uważa się za ogólną odpowiedź na wiele różnych stresów, takich jak stres oksydacyjny [ 52 ].
U ludzi i innych ssaków wiele bodźców środowiskowych wywołuje promieniowanie ultrafioletowe [ 53 ], promieniowanie jonizujące [ 54 ] i promieniowanie laserowe [ 55 ], które są spowodowane stresami komórkowymi i zmieniają poziomy Hsp90 i 70.
Promieniowanie niejonizujące powoduje również zmiany HSP w różnych tkankach, w tym w mózgu [ 56 ], mięśniu sercowym [ 57 ], jądrach [ 5 ] i skórze [ 58 ].
Badania opisały te odkrycia jako adaptację lub ponowne dostosowanie komórkowych białek stresu przed przygotowaniem maszynerii komórkowej do odpowiedniej zmiany środowiskowej.
Niewielkie, przejściowe korekty obwodów mogą więc mieć decydujący wpływ na ogólną tolerancję naprężeń [ 59 , 60 ].
Istnieją również doniesienia, że pola elektromagnetyczne o niskiej częstotliwości (0–300 Hz) i RF (10 MHz – 300 GHz)
zmieniają przepuszczalność bariery krew-mózg [ 61 , 62 , 63 ].
Jednocześnie te zmiany bariery krew-mózg mogą prowadzić do nadmiernej akumulacji metali ciężkich, a zwłaszcza żelaza w mózgu.
Efekt ten może wywołać kilka zaburzeń neuronalnych [ 64 , 65 ].
Niektóre badania wykazały, że uszkodzenie DNA i zakłócenie bariery krew-mózg są ze sobą powiązane, a stany ze spektrum autyzmu są związane z ekspozycją na pola elektromagnetyczne.
Zakłócenia płodności i reprodukcji związane z EMF / RFR mogą być również związane z rosnącą częstością występowania zaburzeń ze spektrum autyzmu [ 66 , 67 , 68 ].
Stres oksydacyjny odgrywa ważną rolę w procesie uszkodzenia DNA, ogólnej i specyficznej ekspresji genów, oraz apoptozie komórek.
Mózg ma wysoką przemianę materii, co czyni go bardziej podatnym na uszkodzenia spowodowane przez RFT i uszkodzenia oksydacyjne w porównaniu z innymi narządami [ 69 ].
Nadmierne ilości RFT w tkankach mogą prowadzić do martwicy, śmierci neuronów i uszkodzenia neuronów w tkance mózgowej, a także do zaburzeń neurologicznych, takich jak choroba Alzheimera, uszkodzenie rdzenia kręgowego, stwardnienie rozsiane i padaczka [ 70 ] (Ryc.2).
W kilku badaniach zaobserwowano uszkodzenia neuronów i straty komórkowe spowodowane ekspozycją na EMF w wielu obszarach mózgu, w tym w korze, zwojach podstawy mózgu, hipokampie i móżdżku [ 71 , 72 , 73 , 74 , 75 ].
W jednym badaniu epidemiologicznym ustalono związek między stwardnieniem zanikowym bocznym, a ekspozycją na pola elektromagnetyczne o dużym natężeniu, ale nie zaobserwowano korelacji z innymi chorobami neurodegeneracyjnymi [ 76 ].
Rubin i współpracownicy zauważyli, że poziom bólu głowy może wzrosnąć podczas ekspozycji, ale zmniejszył się natychmiast po zaprzestaniu ekspozycji [ 77 ].
Haynal i Regli zasugerowali, że ekspozycja na ekstremalnie niskie częstotliwości (ELF) -EMF może być związana ze stwardnieniem zanikowym bocznym, śmiertelnym zaburzeniem neurodegeneracyjnym [ 78 ].
Maskey i współpracownicy zbadali wpływ częstotliwości 835 MHz na mózg w różnych czasach ekspozycji i zaobserwowali znaczną utratę komórek piramidalnych w regionie CA1 hipokampu [ 79 ].
Inne badanie kliniczne przeprowadzone przez Villeneuve i wsp. donieśli o 5,3-krotnym zwiększeniu ryzyka wystąpienia jednego typu raka mózgu, glejaka wielopostaciowego, u osób narażonych na działanie pola elektromagnetycznego, ale nie odnotowali zwiększonego ryzyka innych nowotworów mózgu [ 80 ].
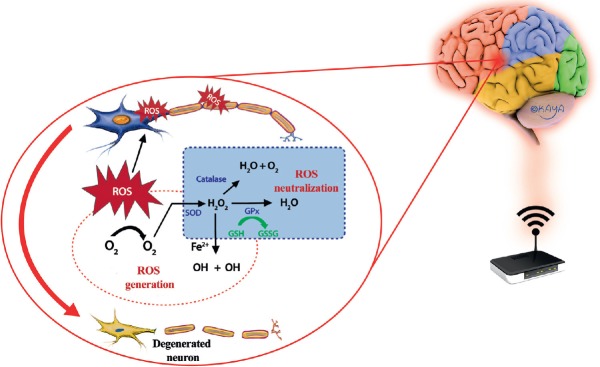
Ryc.2
Rola EMF emitowanego z kilku urządzeń, obrazująca wzrost wytwarzania RFT i wynikający z tego stres oksydacyjny w ośrodkowym układzie nerwowym wynikający z niezdolności układu obronnego antyoksydantów do radzenia sobie ze wzrostem RFT [ 81 ].
Niektóre badania wykazały, że ekspozycja na mikrofale nie wywoływała sama przez się wykrywalnego efektu genotoksycznego i donosiła o interferencji z mechanizmami naprawy DNA [ 82 , 83 , 84 , 85 ].
Uszkodzenia oksydacyjne w DNA powstają w wyniku interakcji pomiędzy wolnymi rodnikami a DNA, z dodatkiem zasad lub abstrakcji atomów wodoru z ugrupowania cukrowego.
Zmodyfikowane nukleotydy pojawiają się jako produkty uszkodzenia (8-OH-dG), gdy DNA jest modyfikowane przez uszkodzenie oksydacyjne wywołane przez reaktywne cząsteczki tlenu [ 86 ].
Produkty te są markerami stresu oksydacyjnego mierzonymi metodami analitycznymi [ 87 , 88 ].
Agarwal i Saleh oraz Aitken i wsp. donieśli, że RFT może mieć szkodliwy wpływ na DNA plemników i inne biocząsteczki, białka i lipidy, prowadząc w konsekwencji do niepłodności męskiej [ 89 , 90 ].
W tym samym czasie mężczyźni noszą telefony w kieszeni lub na pasku, a zatem większość niekorzystnych skutków pola elektromagnetycznego jest widoczna w narządach rozrodczych.
Sepehrimanesh i in. wykazali, że ekspozycja na RF-EMF powoduje wzrost białek jąder u dorosłych, co jest związane z ryzykiem rakotwórczości i uszkodzeniami reprodukcyjnymi [ 6 ].
Zmiany neuroendokrynne wywołane przez pola elektromagnetyczne są kluczowym czynnikiem zmiany funkcji hormonów [ 91 ].
Eroğlu i in. stwierdził, że ekspozycja na promieniowanie telefonu komórkowego zmniejsza ruchliwość i zmienia morfologię izolowanych plemników.
Omówili również wpływ pól elektromagnetycznych na niepłodność kobiet [ 92 ].
Goldhaber i in. zgłosili znaczący wzrost nieprawidłowości płodu i samoistnych poronień u kobiet w ciąży narażonych na działanie pola elektromagnetycznego [ 93 ].
Wiele z tych efektów może wystąpić z powodu zmian hormonalnych [ 94 , 95 ].
Badania nad wpływem pola elektromagnetycznego na tkanki omówione tutaj przedstawiono w tabelach WcześniejszeTabele 11 i Wcześniejszei 22.
Niektóre badania eksperymentalne dotyczące utleniającego wpływu pola elektromagnetycznego.
(Ze względów wizualnych Tabela 1 otworzy się w nowym oknie.)
Tabela 1
> otwórz w nowym oknie:
Niektóre badania kliniczne dotyczące oksydacyjnych skutków pola elektromagnetycznego.
(Ze względów wizualnych Tabela 2 otworzy się w nowym oknie.)
Tabela 2
> otwórz w nowym oknie:
4. System obrony przeciwutleniającej i pola elektromagnetycznego
W organizmach rozwinęły się systemy obrony przeciwutleniającej, które kontrolują powstawanie wolnych rodników i zapobiegają szkodliwemu działaniu tych cząsteczek [ 122 ].
Te przeciwutleniacze zmniejszają lub osłabiają mechanizm uszkadzania RFT poprzez swoje działanie zmiatające wolne rodniki [ 123 ].
Zidentyfikowano dwa główne mechanizmy działania przeciwutleniaczy [ 124 ].
Pierwszy to mechanizm rozrywania łańcucha, w którym pierwotny przeciwutleniacz uwalnia elektron do wolnego rodnika znajdującego się w układach.
Drugi mechanizm obejmuje eliminację inicjatorów form ROS / reaktywnego azotu (drugorzędowych przeciwutleniaczy) poprzez tłumienie katalizatorów inicjujących łańcuch.
Przeciwutleniacze mogą również wpływać na systemy biologiczne poprzez różne mechanizmy, w tym uwalnianie elektronów, chelatację jonów metali, ko-przeciwutleniacze lub poprzez utrzymywanie ekspresji genów [ 125 ].
Jeśli te mechanizmy obronne przeciwutleniaczy zostaną osłabione przez ekspozycję na czynnik powodujący nadprodukcję RFT, w tym EMF, przeciwutleniacze mogą być niewystarczające lub tworzenie się wolnych rodników może wzrosnąć do tego stopnia, że osłabia zdolności obronne przeciwutleniaczy [ 10 ].
Nazywa się to stresem oksydacyjnym.
Pola elektromagnetyczne mogą inicjować różne zmiany biochemiczne i fizjologiczne, w tym stres oksydacyjny, w układach różnych gatunków.
Kilka badań w literaturze wskazuje, że receptory błony komórkowej są możliwymi celami dla oddziaływań polowych [ 126 , 127 ].
Ogólnie przeciwutleniacze podzielono na grupy egzogenne (karoten, C i witamina E) oraz grupy endogenne (melatonina (MEL)), SOD, GSH-Px, CAT, w tym; białko (MEL), witaminy (witamina C), pierwiastki śladowe (Mg, Se), kompleksy związków, hydrofilowe (kwas askorbinowy, moczan, flawonoidy) i hydrofobowe (β-karoten, α-tokoferol), z bezpośrednim wpływem (SOD) , CAT) i efekty pośrednie (witamina E).
Do przeciwutleniaczy zalicza się substancje działające na błonę (witamina A i E, β-karoten), krążenie (witamina C, aminokwasy i polifenole), cytozol (koenzym Q10) [ 122 , 128 ].
4.1. Glutation
Glutation (GSH) jest endogennym przeciwutleniaczem i ważnym środkiem obrony komórkowej przed uszkodzeniami oksydacyjnymi.
GSH reaguje z wolnymi rodnikami w komórce i ogranicza wnikanie nadtlenków wodoru [ 129 ].
GSH zapobiega również utlenianiu grup sulfhydrylowych w strukturze białka.
Poziomy GSH w tkankach są często używane jako marker do pomiaru radykalnych uszkodzeń.
Działa jako substrat dla enzymów przeciwutleniających, które powodują odporność na uszkodzenia wywołane przez rodniki, zachowując się jak zmiatacz rodników.
GSH jest szczególnie ważny dla aktywności peroksydazy glutationowej (GSH-Px), reduktazy glutationu (GR) i transferazy S-glutationu (GST).
W procesie stresu oksydacyjnego poziom GSH spada, a disiarczek glutationu wzrasta.
W tym przypadku gromadzenie się nadtlenku wodoru (H 2 O 2 ) jest usuwane przez działanie reduktazy i peroksydazy glutationowej (GSH-Px).
GSH-Px jest również ważnym enzymem, który zapobiega uszkodzeniom komórek fagocytarnych powodowanym przez wolne rodniki.
Spadek aktywności GSH-Px prowadzi do gromadzenia się nadtlenku wodoru i uszkodzenia komórek.
GSH-Px zapobiega również inicjacji peroksydacji lipidów [ 65 ].
Wiadomo, że EMF emitowane przez telefony komórkowe jest związane z obniżonym poziomem GSH w tkance mózgowej i krwi [ 97 ].
Jednak obniżony poziom GSH we krwi można prawdopodobnie wyjaśnić zwiększonym tempem utleniania i stosowaniem GSH podczas eliminacji lipidów i innych nadtlenków [ 130 ].
Awad i Hassan badali mózgi szczurów narażonych na działanie pola elektromagnetycznego o częstotliwości 900 MHz z telefonów komórkowych przez 1 godzinę dziennie przez tydzień.
Zaobserwowali wzrost peroksydacji lipidów po ekspozycji na telefony komórkowe [ 131 ].
Aydın i Akar badali wpływ EMF 900 MHz przez 2 godziny dziennie przez 45 dni na narządy limfatyczne u niedojrzałych i dojrzałych szczurów.
Poinformowali, że aktywność CAT i GPx znacznie spadła w porównaniu z grupą kontrolną.
Podobnie, wzrost peroksydacji lipidów i jednoczesne obniżenie poziomu GSH obserwowano we wszystkich narządach limfoidalnych po ekspozycji na EMF, co sugeruje, że podwyższony poziom peroksydacji lipidów mógł być konsekwencją wyczerpania zapasów GSH [ 32 ].
Luo i in. zbadali, czy ochronny wpływ LSPCs wykonywanych przez zgłębnik doustny na uszkodzenie stresu oksydacyjnego wywołane ekspozycją na ELF-EMF.
Zgodnie z wynikami, aktywność GST była znacznie obniżona w grupie ELF-EMF w porównaniu z grupą kontrolną.
Odkryli, że LSPC mogą skutecznie zapobiegać uszkodzeniom wywołanym stresem oksydacyjnym - spowodowanym ekspozycją na ELF-EMF, może to być związane ze zdolnością do usuwania wolnych rodników i indukowania aktywności enzymów antyoksydacyjnych [ 132 ].
Singh i in. zbadali biochemiczny mechanizm interakcji pola elektromagnetycznego telefonu komórkowego 900 MHz z tworzeniem korzeni hipokotyli fasoli mung.
Uzyskane wyniki wykazały regulację aktywności enzymów antyoksydacyjnych, takich jak CAT i GR, które chronią przed uszkodzeniami oksydacyjnymi indukowanymi przez EMF [ 133 ].
Sepehrimanesh i in. zbadali wpływ ekspozycji na pole elektromagnetyczne (EMF) 900 MHz na poziom enzymów antyoksydacyjnych w surowicy szczura i jądrach.
Zaobserwowali, że po 30 dniach ekspozycji zarówno aktywność SOD, jak i GPx zmniejszyła się w grupie długotrwałej ekspozycji na EMF [ 134 ].
W innym badaniu ekspozycja na RF-EMF spowodowała wzrost odpowiedzi przeciwutleniającej na stres poprzez wzrost aktywności CAT i GR, co doprowadziło do powstania uszkodzeń oksydacyjnych lipidów i białek [ 135 ].
4.2. Catalase
CAT to powszechnie występujący enzym w organizmach narażonych na działanie tlenu, takich jak warzywa, owoce i mięso.
Katalizuje reakcję degradacji nadtlenku wodoru do wody i tlenu.
Jest kluczowym enzymem w ochronie komórki przed uszkodzeniami oksydacyjnymi wywoływanymi przez RFT.
CAT wywiera aktywność peroksydazy in vivo.
Może również katalizować reakcję utleniania nadtlenkiem wodoru wielu metabolitów i toksyn, nie wyłączając formaldehydu, kwasu mrówkowego, fenoli, aldehydu octowego i alkoholi.
Jego podstawową funkcją jest usuwanie nadtlenku wodoru i nadtlenku ROOH z tlenu cząsteczkowego w celu zapobieżenia nieodwracalnemu uszkodzeniu membran [ 136 ].
Wiadomo, że EMF wpływa na systemy biologiczne poprzez zwiększenie ROS, co powoduje stres oksydacyjny poprzez zmianę poziomów CAT w tkankach [ 137 , 138 , 139 ].
Odaci i współpracownicy zaobserwowali spadek poziomów CAT w grupie narażonej na działanie pola elektromagnetycznego.
Ekspozycja na EMF w okresie prenatalnym również spowodowała stres oksydacyjny w rozwijających się embrionach szczurów.
Ten stres oksydacyjny utrzymywał się do 21 dnia po urodzeniu [ 140 ].
Vuokko i in. podali, że ekspozycja na EMF doprowadziła do depresji układów przeciwutleniających z powodu zwiększonej peroksydacji lipidów i wytwarzania wolnych rodników [ 141 ].
Telefony komórkowe wywoływały uszkodzenia oksydacyjne w żywej komórce, zwiększając poziom oksydazy ksantynowej i aktywności grup karbonylowych oraz zmniejszając aktywność CAT.
Leczenie MEL znacząco zapobiega uszkodzeniom oksydacyjnym w mózgu [ 142 ].
Özgüner i inni podali, że ekspozycja na EMF prowadzi do uszkodzenia tkanki nerek poprzez podwyższenie poziomu tlenku azotu i dialdehydu malonowego (MDA) [ 143 ].
4.3. Dysmutaza ponadtlenkowa
SOD jest enzymem katalizującym reakcję, w której toksyczny rodnik ponadtlenkowy (O 2 -) zostaje podzielony na tlen cząsteczkowy (O 2 ) lub nadtlenek wodoru (H 2 O 2 ).
Ponadtlenek powstaje jako produkt uboczny w wyniku metabolizmu tlenu, co prowadzi do kilku rodzajów uszkodzeń komórek.
U ludzi można spotkać trzy formy SOD; SOD 1 występuje w cytoplazmie, SOD 2 w mitochondriach, a SOD 3 w przedziale zewnątrzkomórkowym. SOD występuje w cytozolu i mitochondriach i dezaktywuje istniejące rodniki ponadtlenkowe, a także chroni komórki przed szkodliwym działaniem rodników ponadtlenkowych [ 144 ].
Badania wykazały, że mózg szczura jest podatny na skutki ekspozycji na ELF-EMF.
Zmniejszona aktywność CAT i SOD po ekspozycji sugeruje, że EMF może zmieniać poziomy przeciwutleniaczy w mózgu [ 145 ].
Gambari i in. podali, że 50-dniowa ekspozycja na EMF powoduje stres oksydacyjny poprzez zwiększenie poziomu MDA i zmniejszenie aktywności SOD oraz zaobserwowali, że leczenie witaminą E zapobiega stresowi oksydacyjnemu i peroksydacji lipidów w istocie czarnej [ 146 ].
Inne badanie wykazało obniżone poziomy enzymów przeciwutleniających i podwyższone poziomy RFT w nerkach szczurów narażonych na EMF 900 MHz przez 30 minut dziennie przez 1 miesiąc [ 143 ].
5. Przeciwutleniacze łagodzą potencjalne ryzyko narażenia na pola elektromagnetyczne
Zastosowanie przeciwutleniacza uzupełnionego ekspozycją na pole elektromagnetyczne poprawiło hydrofilową, lipofilową i enzymatyczną pojemność antyoksydacyjną krwi oraz częściowo skompensowało te zmiany [ 147 , 148 ].
Witamina E (tokoferol) jest jednym z najważniejszych przeciwutleniaczy.
Związki witaminy E, w tym alfa, beta, gamma i delta tokoferole, są rozpuszczalne w lipidach.
Witamina E jest magazynowana w wątrobie i pełni wiele funkcji.
Jej główną funkcją przeciwutleniającą jest zapobieganie peroksydacji lipidów [ 149 ].
Kilka badań wykazało korzystne działanie witaminy E obserwowane poprzez zmniejszenie zmiany zdolności antyoksydacyjnej w stosunku do szkodliwego wpływu pola elektromagnetycznego [ 150 , 151 ].
Ghambari i inni zaobserwowali, że ekspozycja na 3-MT EMF prowadzi do stresu oksydacyjnego poprzez zmniejszenie aktywności SOD i stwierdzili, że leczenie witaminą E zapobiega peroksydacji lipidów w istocie czarnej [ 146 ].
Mohammadnejad i inni zbadali ultrastrukturalne zmiany w grasicy po ekspozycji na pola elektromagnetyczne i zbadali ochronne działanie witaminy E w zapobieganiu tym zmianom.
Ich wyniki wykazały, że ekspozycja na EMF spowodowała uszkodzenie układu odpornościowego i że spożycie witaminy E może zapobiegać ultrastrukturalnym zmianom w tkankach [ 152 ].
Witamina B9 (kwas foliowy i kwas foliowy) ma kluczowe znaczenie dla wielu funkcji w organizmie człowieka, od produkcji nukleotydów po remetylację homocysteiny. U ludzi kwas foliowy jest niezbędny, aby organizm mógł wytwarzać lub naprawiać DNA oraz metylować DNA, oprócz funkcji kofaktora w różnych reakcjach biologicznych. Ponadto witamina ta posiada właściwości przeciwutleniające [ 153 ]. Jest to szczególnie istotne w okresach szybkiego podziału i wzrostu komórek. Kwas foliowy (FA) jest szczególnie potrzebny w ciąży i do rozwoju mózgu niemowlęcia. Jest również niezbędna do tworzenia nowych komórek [ 154 ]. Nasze poprzednie badanie ujawniło, że FA zapobiega niekorzystnym skutkom ekspozycji na EMF, zapobiegając zmniejszeniu liczby komórek w móżdżku i mózgu. Kıvrak zaobserwował, że EMF wywołuje uszkodzenia oksydacyjne poprzez zwiększenie poziomu aktywności CAT i zmniejszenie aktywności GPx. Zauważyli również, że terapia FA znacząco zapobiegała uszkodzeniom oksydacyjnym w mózgu [ 75 ] (Ryc.3).
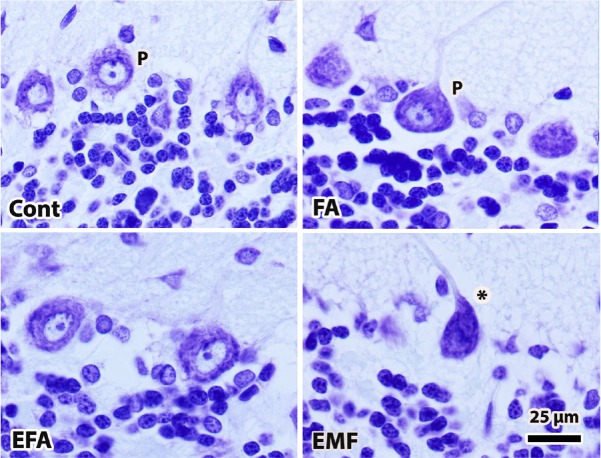
Ryc.3 Obrazy tkanek móżdżku z grupy kontrolnej (Cont), ekspozycji na EMF, FA i EMF + FA (EFA).
Litera P oznacza zdrowe komórki Purkinjego w grupach Cont i FA.
Martwicę komórek Purkinjego oznaczono gwiazdką w grupie EMF [ 72 ].
MEL to hormon wydzielany przez szyszynkę, znany również jako N-acetylo-5-metoksy tryptamina.
Działa jako pierwsza linia obrony przed stresem oksydacyjnym [ 155 ].
Hormon ten działa razem z innymi przeciwutleniaczami, takimi jak CAT, SOD i GPx, aby zwiększyć skuteczność każdego przeciwutleniacza.
Jako zmiatacz wolnych rodników posiada właściwości amfifilowe i może łatwo przenikać przez błony komórkowe i barierę krew-mózg [ 156 , 157 , 158 ].
Wcześniejsze badania wykazały, że MEL wykazuje działanie ochronne przed stresem oksydacyjnym wywołanym przez pola elektromagnetyczne [ 159 , 160 , 161 ].
Koc i in. wykazali, że MEL zmniejsza uszkodzenia neuronów w hipokampie indukowane przez EMF 900 MHz.
Ozguner i in. wykazali, że ekspozycja na EMF 900 MHz prowadzi do łagodnych zmian skórnych [ 162 ].
Ulubay i in. stwierdził, że ekspozycja na EMF 900 MHz w nerkach szczura w okresie prenatalnym powoduje nie tylko wzrost całkowitej objętości nerek, ale także zmniejszenie liczby kłębuszków nerkowych.
Stwierdzono, że zastosowanie MEL zapobiega negatywnemu wpływowi pola elektromagnetycznego na nerki [ 148 ].
Lai i Singh wykazali, że MEL zapobiega uszkodzeniom DNA wywołanym przez pola elektromagnetyczne, wynikającym z generowania wolnych rodników w komórkach mózgowych szczurów [ 31 ].
6. Wniosek
Biologiczne skutki narażenia na pola elektromagnetyczne są przedmiotem szczególnego zainteresowania badawczego.
Wyniki ostatnich badań nie tylko jasno pokazują, że ekspozycja na pola elektromagnetyczne wywołuje stres oksydacyjny w różnych tkankach, ale także powoduje znaczące zmiany poziomu markerów antyoksydacyjnych we krwi.
Zmęczenie, ból głowy, zmniejszona zdolność uczenia się i upośledzenie funkcji poznawczych należą do objawów spowodowanych przez pole elektromagnetyczne.
W związku z tym organizm ludzki powinien być chroniony przed narażeniem na działanie pola elektromagnetycznego ze względu na związane z tym ryzyko.
Jak donoszono w wielu badaniach, ludzie mogą używać różnych przeciwutleniaczy, takich jak witamina E, MEL i FA, aby zapobiec potencjalnym niekorzystnym skutkom ekspozycji na pole elektromagnetyczne.
Bibliografia
[1] Fragopoulou AF, Koussoulakos SL, Margaritis LH. Zmienności szkieletu czaszkowego i pozaczaszkowego wywołane w zarodkach myszy przez promieniowanie telefonu komórkowego. Patofizjologia. 2010; 17 : 169–77. [ PubMed ] [ Google Scholar ]
[2] Megha K, Deshmukh PS, Banerjee BD, Tripathi AK, Abegaonkar MP. Stres oksydacyjny, zaburzenia funkcji poznawczych i zapalenie w mózgu szczurów Fischera wywołały promieniowanie mikrofalowe. Indian J Exp Biol. 2012; 50 : 889–96. [ PubMed ] [ Google Scholar ]
[3] Challis LJ. Mechanizmy interakcji między polami RF a tkanką biologiczną. Bioelektromagnetyka. 2005; (Suppl 7): S98–106. [ PubMed ] [ Google Scholar ]
[4] Leszczyński D, Joenvaara S, Reivinen J, Kuokka R. Nietermiczna aktywacja szlaku stresu hsp27 / p38MAPK przez promieniowanie telefonu komórkowego w ludzkich komórkach śródbłonka: mechanizm molekularny skutków związanych z rakiem i barierą krew-mózg. Różnicowanie. 2002; 70 : 120–9. [
PubMed ] [ Google Scholar ]
[5] Sepehrimanesh M, Kazemipour N, Saeb M, Nazifi S. Analiza proteomu jąder szczura po 30-dniowej ekspozycji na promieniowanie pola elektromagnetycznego 900 MHz. Elektroforeza. 2014; 35 : 3331–8. [ PubMed ] [ Google Scholar ]
[6] Sepehrimanesh M, Kazemipour N, Saeb M, Nazifi S, Davis DL. Analiza proteomiczna ciągłego narażenia na pole elektromagnetyczne o częstotliwości 900 MHz w tkance jąder: szczurzy model ekspozycji na telefon komórkowy. Environ Sci Pollut Res Int. 2017; 24 : 13666–73. [ PubMed ] [ Google Scholar ]
[7] Tkalec M, Malaric K, Pevalek-Kozlina B. Ekspozycja na promieniowanie o częstotliwości radiowej wywołuje stres oksydacyjny u rzęsy Lemna minor L. Sci Total Environ. 2007; 388 : 78–89. [ PubMed ] [ Google Scholar ]
[8] Cui K, Luo X, Xu K, Ven Murthy MR. Rola stresu oksydacyjnego w neurodegeneracji: najnowsze osiągnięcia w metodach oznaczania stresu oksydacyjnego i nutraceutycznych przeciwutleniaczy. Prog Neuropsychopharmacol Biol Psychiatry. 2004; 28 : 771–99. [ PubMed ] [ Google Scholar ]
[9] Halliwell B. Rola wolnych rodników w chorobach neurodegeneracyjnych: implikacje terapeutyczne w leczeniu przeciwutleniaczy. Starzenie się narkotyków. 2001; 18 : 685–716. [ PubMed ] [ Google Scholar ]
[10] Calcabrini C, Mancini U, De Bellis R, Diaz AR, Martinelli M, Cucchiarini L, et al. Wpływ pól elektromagnetycznych o skrajnie niskich częstotliwościach na aktywność przeciwutleniającą w linii komórek ludzkich keratynocytów NCTC 2544. Biotechnol Appl Biochem. 2016 [ PubMed ] [ Google Scholar ]
[11] Venugopal SK, Devaraj S, Yang T, Jialal I. alfa-tokoferol zmniejsza uwalnianie anionów ponadtlenkowych w ludzkich monocytach w warunkach hiperglikemii poprzez hamowanie kinazy białkowej C-alfa. Cukrzyca. 2002; 51 : 3049–54. [ PubMed ] [ Google Scholar ]
[12] Halliwell B. Stres oksydacyjny i rak: czy posunęliśmy się naprzód. Biochem J. 2007; 401 : 1–11. [ PubMed ] [ Google Scholar ]
[13] Ames BN, Shigenaga MK, Hagen TM. Utleniacze, przeciwutleniacze i choroby zwyrodnieniowe starzenia. P Natl Acad Sci USA. 1993; 90 : 7915–22. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[14] Basaga HS. Biochemiczne aspekty wolnych rodników. Biochem Celi Biol. 1990; 68 : 989–98. [ PubMed ] [ Google Scholar ]
[15] Stadtman ER, Oliver CN. Katalizowane metalami utlenianie białek. J Biol Chem. 1991; 256 : 2005. [ PubMed ] [ Google Scholar ]
[16] Feychting M, Ahlbom A. Pola magnetyczne i nowotwory u dzieci mieszkających w pobliżu szwedzkich linii wysokiego napięcia. Jestem J Epidemiol. 1993; 138 : 467–81. [ PubMed ] [ Google Scholar ]
[17] Ozguner F, Altinbas A, Ozaydin M, Dogan A, Vural H, Kisioglu AN, et al. Stres oksydacyjny mięśnia sercowego wywołany telefonem komórkowym: ochrona przez nowy środek przeciwutleniający, ester fenetylowy kwasu kawowego. Toxicol Ind Health. 2005; 21 : 223–30. [ PubMed ] [ Google Scholar ]
[18] Valberg PA, van Deventer TE, Repacholi MH. Raport grupy roboczej: narażenie stacji bazowych i sieci bezprzewodowych na częstotliwości radiowe (RF) oraz konsekwencje zdrowotne. Environ Health Perspect. 2007; 115 : 416–24. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[19] Nishiyama HIM, Kato N. Relay-by-smartphone: realizacja komunikacji między urządzeniami w wielu sklepach. IEEE Com Mag. 2014; 52 : 56–65. [ Google Scholar ]
[20] Manikonda PK, Rajendra P, Devendranath D, Gunasekaran B, Channakeshava Aradhya RSS i in. Wpływ pól magnetycznych o skrajnie niskiej częstotliwości na sygnalizację Ca2 + i funkcje receptora NMDA w hipokampie szczura. Neurosci Lett. 2007; 413 : 145–9. [ PubMed ] [ Google Scholar ]
[21] Soderqvist F, Carlberg M, Hardell L. Stosowanie telefonów bezprzewodowych i poziomy S100 B w surowicy: opisowe badanie przekrojowe wśród zdrowych dorosłych Szwedów w wieku 18-65 lat. Sci Total Environ. 2009; 407 : 798–805. [ PubMed ] [ Google Scholar ]
[22] Behari J. Biologiczne reakcje narażenia na częstotliwości telefonów komórkowych. Indian J Exp Biol. 2010; 48 : 959–81. [ PubMed ] [ Google Scholar ]
[23] Gherardini L, Ciuti G, Tognarelli S, Cinti C. Poszukiwanie idealnej fali: wpływ pól elektromagnetycznych o częstotliwości radiowej na komórki. Int J Mol Sci. 2014; 15 : 5366–87. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[24] Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P. 4. wydanie. Nowy Jork: Garland Science; 2002. Transport małych cząsteczek i właściwości elektryczne błon - biologia molekularna komórki; p. 651. [ Google Scholar ]
[25] Challis LJ. Mechanizmy interakcji między polami RF a tkanką biologiczną. Bioelektromagnetyka. 2005: S98–106. [ PubMed ] [ Google Scholar ]
[26] Georgiou CD. Stres oksydacyjny wywołany biologicznym uszkodzeniem przez pola elektromagnetyczne o niskim poziomie: mechanizm spolaryzowania spinów elektronów par wolnych rodników i amplifikacji biochemicznej. Eur J Oncol. 2010; 5 : 66–113. [ Google Scholar ]
[27] Lobo V, Patil A, Phatak A, Chandra N. Wolne rodniki, przeciwutleniacze i żywność funkcjonalna: wpływ na zdrowie człowieka. Pharmacogn Rev. 2010; 4 : 118–26. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[28] Chen G, Upham BL, Sun W, Chang CC, Rothwell EJ, Chen KM, et al. Wpływ ekspozycji na pole elektromagnetyczne na indukowane chemicznie różnicowanie zaprzyjaźnionych komórek erytroleukemii. Environ Health Perspect. 2000; 108 : 967–72. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google
Scholar ]
[29] Park JE, Seo YK, Yoon HH, Kim CW, Park JK, Jeon S. Pola elektromagnetyczne indukują różnicowanie neuronalne ludzkich mezenchymalnych komórek macierzystych pochodzących ze szpiku kostnego poprzez aktywację EGFR za pośrednictwem ROS. Neurochem Int. 2013; 62 : 418–24. [ PubMed ] [ Google Scholar ]
[30] Jajte J, Zmyslony M. [Rola melatoniny w molekularnym mechanizmie słabych, statycznych i skrajnie niskich częstotliwości (50 Hz) pól magnetycznych (ELF)] Med Pr. 2000; 51 : 51–7. [ PubMed ] [ Google Scholar ]
[31] Lai H, Singh NP. Wywołane polem magnetycznym pęknięcia nici DNA w komórkach mózgowych szczura. Environ Health Perspect. 2004; 112 : 687–94. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[32] Aydin B, Akar A. Wpływ pola elektromagnetycznego 900 MHz na parametry stresu oksydacyjnego w narządach limfoidalnych szczura, leukocytach polimorfojądrowych i osoczu. Arch Med Res. 2011; 42 : 261–7. [ PubMed ] [ Google Scholar ]
[33] Dasdag S, Akdag MZ. Związek między częstotliwościami radiowymi emitowanymi przez technologie bezprzewodowe a stresem oksydacyjnym. J Chem Neuroanat. 2016; 75 : 85–93. [ PubMed ] [ Google Scholar ]
[34] Zmyslony M, Politanski P, Rajkowska E, Szymczak W, Jajte J. Ostra ekspozycja na promieniowanie elektromagnetyczne CW o częstotliwości 930 MHz in vitro wpływa na poziom reaktywnych form tlenu w limfocytach szczura poddanych działaniu jonów żelaza. Bioelektromagnetyka. 2004; 25 : 324–8. [ PubMed ] [ Google Scholar ]
[35] Wu W, Yao K, Wang KJ, Lu DQ, He JL, Xu LH, i wsp. Blokowanie wytwarzania reaktywnych form tlenu przez telefon komórkowy o częstotliwości 1800 MHz i uszkodzenia DNA w komórkach nabłonka soczewki przez szumowe pola magnetyczne. Zhejiang Da Xue Bao Yi Xue Ban. 2008; 37 : 34–8. [ PubMed ] [ Google Scholar ]
[36] Yao K, Wu W, Wang K, Ni S, Ye P, Yu Y i wsp. Szum elektromagnetyczny hamuje uszkodzenia DNA wywołane promieniowaniem o częstotliwości radiowej i wzrost reaktywnych form tlenu w komórkach nabłonka ludzkiej soczewki. Mol Vis. 2008; 14 : 964–9. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[37] Yao K, Wu W, Yu Y, Zeng Q, He J, Lu D i wsp. Wpływ nałożonego szumu elektromagnetycznego na uszkodzenie DNA komórek nabłonka soczewki wywołane promieniowaniem mikrofalowym. Zainwestuj Ophthalmol Vis Sci. 2008; 49 : 2009–15. [ PubMed ] [ Google Scholar ]
[38] Oktem F, Ozguner F, Mollaoglu H, Koyu A, Uz E. Uszkodzenia oksydacyjne w nerkach wywołane przez telefon komórkowy emitujący 900 MHz: ochrona przez melatoninę. Arch Med Res. 2005; 36 : 350–5. [ PubMed ] [ Google Scholar ]
[39] Friedman J, Kraus S, Hauptman Y, Schiff Y, Seger R. Mechanizm krótkotrwałej aktywacji ERK przez pola elektromagnetyczne na częstotliwościach telefonów komórkowych. Biochem J. 2007; 405 : 559–68. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[40] Fang YZ, Yang S, Wu G. Wolne rodniki, przeciwutleniacze i odżywianie. Odżywianie. 2002; 18 : 872–9. [ PubMed ] [ Google Scholar ]
[41] Fridovich I. Podstawowe aspekty reaktywnych form tlenu, czyli o co chodzi z tlenem. Ann NY Acad Sci. 1999; 893 : 13–8. [ PubMed ] [ Google Scholar ]
[42] Mattson MP. Katalizowane metalami zakłócenie sygnalizacji białek błonowych i lipidów w patogenezie zaburzeń neurodegeneracyjnych. Ann NY Acad Sci. 2004; 1012 : 37–50. [ PubMed ] [ Google Scholar ]
[43] Halliwell B. Wolne rodniki i przeciwutleniacze: osobisty pogląd. Nutr Rev. 1994; 52 : 253–65. [ PubMed ] [ Google Scholar ]
[44] Zmyslony M, Jajte JM. Rola wolnych rodników w mechanizmach funkcji biologicznych narażonych na działanie słabych, stałych i sieciowych pól magnetycznych. Med Pr. 1998; 49 : 177–86. [ PubMed ] [ Google Scholar ]
[45] Hoyto A, Luukkonen J, Juutilainen J, Naarala J. Proliferation, oksydacyjny stres i śmierć komórek w komórkach narażonych na promieniowanie o częstotliwości radiowej 872 MHz i utleniacze. Radiat Res. 2008; 170 : 235–43. [ PubMed ] [ Google Scholar ]
[46] Collins T. Śródbłonkowy czynnik jądrowy kappa B i inicjacja zmiany miażdżycowej. Lab Invest. 1993; 68 : 499–508. [ PubMed ] [ Google Scholar ]
[47] Lusis AJ, Navab M. Utlenianie lipoprotein i ekspresja genów w ścianie tętnicy: nowe możliwości interwencji farmakologicznej w miażdżycy tętnic. Biochem Pharmacol. 1993; 46 : 2119–26. [ PubMed ] [ Google Scholar ]
[48] Steinberg D, Parthasarathy S, Carew TE, Khoo JC, Witztum JL. Poza cholesterolem: modyfikacje lipoprotein o niskiej gęstości, które zwiększają jej miażdżycę. N Engl J Med. 1989; 320 : 915–24. [ PubMed ] [ Google Scholar ]
[49] Oh J, Lee YD, Wagers AJ. Starzenie się komórek macierzystych: mechanizmy, regulatory i możliwości terapeutyczne. Nat Med. 2014: 870–80. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[50] Croft RJ, Chandler JS, Burgess AP, Barry RJ, Williams JD, Clarke AR. Ostra praca telefonu komórkowego wpływa na funkcje nerwowe u ludzi. Clin Neurophysiol. 2002; 113 : 1623–32. [ PubMed ] [ Google Scholar ]
[51] Kempson IM, Martin AL, Denman JA, francuski PW, Prestidge CA, Barnes TJ. Wykrywanie obecności zdenaturowanej albuminy surowicy ludzkiej w monowarstwie zaadsorbowanego białka przy użyciu TOF-SIMS. Langmuir. 2010; 26 : 12075–80. [ PubMed ] [ Google Scholar ]
[52] Wu C. Czynniki transkrypcyjne szoku cieplnego: budowa i regulacja. Annu Rev Cell Dev Biol. 1995; 11 : 441–69. [ PubMed ] [ Google Scholar ]
[53] Trautinger F, Kindas-Mugge I, Knobler RM, Honigsmann H. Stress białko w odpowiedzi komórkowej na promieniowanie ultrafioletowe. J Photochem Photobiol B. 1996; 35 : 141–8. [ PubMed ] [ Google Scholar ]
[54] Calini V, Urani C, Camatini M. Nadmierna ekspresja HSP70 jest indukowana promieniowaniem jonizującym w komórkach C3H 10T1 / 2 i chroni przed uszkodzeniem DNA. Toxicol In Vitro. 2003; 17 : 561–6. [ PubMed ] [ Google Scholar ]
[55] Novoselova EG, Cherenkov DA, Glushkova OV, Novoselova TV, Chudnovskii VM, Iusupov VI i in. Wpływ promieniowania laserowego o niskiej intensywności (632,8 nm) na komórki odpornościowe wyizolowane z myszy. Biofizika. 2006; 51 : 509–18. [ PubMed ] [ Google Scholar ]
[56] Jorge-Mora MT, Folgueiras MA, Leiro-Vidal JM, Jorge-Barreiro FJ, Ares-Pena FJ, Lopez-Martin E. Ekspozycja na promieniowanie mikrofalowe 2,45 GHz wywołuje zmiany mózgowe w indukcji białka szoku cieplnego HSP90 u szczurów. Prog Electromagn Res. 2010; 100 : 351–79. [ Google Scholar ]
[57] George I, Geddis MS, Lill Z, Lin H, Gomez T, Blank M, et al. Funkcja mięśnia sercowego poprawiona przez indukcję pola elektromagnetycznego białka stresu hsp 70. J Cell Physiol. 2008; 216 : 816–23. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[58] Shi B, Farboud B, Nuccitelli R, Isseroff RR. Pola elektromagnetyczne o częstotliwości sieci energetycznej nie wywołują zmian w fosforylacji, lokalizacji ani ekspresji 27-kilodaltonowego białka szoku cieplnego w ludzkich keratynocytach. Environ Health Perspect. 2003; 111 : 281–8. [ Bezpłatny artykuł
PMC ] [ PubMed ] [ Google Scholar ]
[59] Ramaglia V, Buck LT. Zależna od czasu ekspresja białek szoku cieplnego 70 i 90 w tkankach beztlenowego żółwia malowanego zachodniego. J Exp Biol. 2004; 207 : 3775–84. [ PubMed ] [ Google Scholar ]
[60] Yang J. Przesunięcia częstotliwości w ciele piezoelektrycznym spowodowane niewielkimi ilościami dodatkowej masy na jego powierzchni. IEEE Trans Ultrason Ferroelectr Freq Control. 2004; 51 : 1199–202. [ PubMed ] [ Google Scholar ]
[61] Grigor'ev IuG. Pola elektromagnetyczne telefonów komórkowych a zdrowie dzieci i młodzieży (sytuacja wymagająca pilnego podjęcia działań) Radiats Biol Radioecol. 2005; 45 : 442–50. [ PubMed ] [ Google Scholar ]
[62] Oscar KJ, Hawkins TD. Mikrofalowa zmiana systemu bariery krew-mózg u szczurów. Brain Res. 1977; 126 : 281–93. [ PubMed ] [ Google Scholar ]
[63] Nittby H, Grafstrom G, Eberhardt JL, Malmgren L, Brun A, Persson BR, et al. Wpływ częstotliwości radiowej i pola elektromagnetycznego o skrajnie niskiej częstotliwości na barierę krew-mózg. Electromagn Biol Med. 2008; 27 : 103–26. [ PubMed ] [ Google Scholar ]
[64] Castelnau PA, Garrett RS, Palinski W, Witztum JL, Campbell IL, Powell HC. Nieprawidłowe odkładanie żelaza związane z peroksydacją lipidów u myszy transgenicznych eksprymujących interleukinę-6 w mózgu. J Neuropathol Exp Neurol. 1998; 57 : 268–82. [ PubMed ] [ Google Scholar ]
[65] Thompson KJ, Shoham S, Connor JR. Żelazo i zaburzenia neurodegeneracyjne. Brain Res Bull. 2001; 55 : 155–64. [ PubMed ] [ Google Scholar ]
[66] Herbert MR, Sage C. Autism and EMF. Prawdopodobieństwo związku patofizjologicznego –- Część I? Patofizjologia. 2013; 20 : 191–209. [ PubMed ] [ Google Scholar ]
[67] Thomas RH, Meeking MM, Mepham JR, Tichenoff L, Possmayer F, Liu S, et al. Metabolit bakterii jelitowych, kwas propionowy, zmienia molekularne gatunki fosfolipidów w mózgu i osoczu: dalszy rozwój gryzoniowego modelu zaburzeń ze spektrum autyzmu. J Zapalenie układu nerwowego. 2012; 9 : 153. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[68] Onore CE, Nordahl CW, Young GS, Van de Water JA, Rogers SJ, Ashwood P. Poziom rozpuszczalnej cząsteczki adhezyjnej komórek śródbłonka płytek krwi-1 i selektyny P jest obniżony u dzieci z zaburzeniami ze spektrum autyzmu. Biol Psychiatry. 2012; 72 : 1020–5. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ] [69] Ozmen I, Naziroglu M, Alici HA, Sahin F, Cengiz M, Eren I. Podawanie morfiny kręgosłupa zmniejsza zawartość kwasów tłuszczowych w rdzeniu kręgowym i mózgu poprzez zwiększenie stresu oksydacyjnego. Neurochem Res. 2007; 32 : 19–25. [ PubMed ] [ Google Scholar ]
[70] Deshmukh PS, Megha K, Banerjee BD, Ahmed RS, Chandna S, Abegaonkar MP, et al. Wykrywanie uszkodzenia wywołanego przez kwas dezoksyrybonukleinowy niskiego poziomu promieniowania mikrofalowego w porównaniu z genotoksycznością w mózgu szczurów fischer. Toxicol Int. 2013; 20 : 19–24. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[71] Odaci E, Bas O, Kaplan S. Wpływ prenatalnej ekspozycji na pole elektromagnetyczne 900 MHz na zakręt zębaty szczurów: badanie stereologiczne i histopatologiczne. Brain Res. 2008; 1238 : 224–9. [ PubMed ] [ Google Scholar ]
[72] Erdem Koc, Kaplan S, Altun G, Gumus H, Gulsum Deniz O, Aydin I, et al. Neuroprotekcyjne działanie melatoniny i kwasów omega-3 na komórki hipokampu prenatalnie wystawione na działanie pól elektromagnetycznych 900 MHz. Int J Radiat Biol. 2016; 92 : 590–5. [ PubMed ] [ Google Scholar ]
[73] Volkow ND, Tomasi D, Wang GJ, Vaska P, Fowler JS, Telang F, et al. Wpływ ekspozycji na sygnał o częstotliwości radiowej telefonu komórkowego na metabolizm glukozy w mózgu. JAMA. 2011; 305 : 808–13. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[74] Tasset I, Medina FJ, Jimena I, Aguera E, Gascon F, Feijoo M, et al. Neuroprotekcyjne skutki pól elektromagnetycznych o skrajnie niskich częstotliwościach na modelu szczura z chorobą Huntingtona: wpływ na czynniki neurotroficzne i gęstość neuronów. Neuroscience. 2012; 209 : 54–63. [ PubMed ] [ Google Scholar ]
[75] Kivrak EG. Samsun, Turcja: Uniwersytet Ondokuz Mayis; 2014. Badanie wpływu boswellia sacra i kwasu foliowego na hipokamp z polami elektromagnetycznymi Praca magisterska. [ Google Scholar ]
[76] Johansen C. Pola elektromagnetyczne a skutki zdrowotne - badania epidemiologiczne raka, chorób ośrodkowego układu nerwowego i chorób serca związanych z arytmią. Scand J Work Environ Health. 2004; 30 (Suplement 1): 1–30. [ PubMed ] [ Google Scholar ]
[77] Rubin GJ, Hahn G, Everitt BS, Cleare AJ, Wessely S. Czy niektórzy ludzie są wrażliwi na sygnały z telefonów komórkowych: u uczestników randomizowane badanie prowokacyjne z podwójnie ślepą próbą. BMJ. 2006; 332 : 886–91. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[78] Haynal A, Regli F. Stwardnienie zanikowe boczne związane z nagromadzonym uszkodzeniem elektrycznym. Confin Neurol. 1964; 24 : 189–98. [ PubMed ] [ Google Scholar ]
[79] Maskey D, Kim M, Aryal B, Pradhan J, Choi IY, Park KS i wsp. Wpływ ekspozycji na promieniowanie o częstotliwości radiowej 835 MHz na białka wiążące wapń w hipokampie mózgu myszy. Brain Res. 2010; 1313 : 232–41. [ PubMed ] [ Google Scholar ]
[80] Villeneuve PJ, Agnew DA, Johnson KC, Mao Y. Canadian Cancer Registries Epidemiology Research G. Rak mózgu i zawodowa ekspozycja na pola magnetyczne wśród mężczyzn: wyniki z kanadyjskiego badania kliniczno-kontrolnego. Int J Epidemiol. 2002; 31 : 210–7. [ PubMed ] [ Google Scholar ]
[81] Othman SB, Yabe T. Użycie nadtlenku wodoru i rodników nadtlenkowych do indukowania stresu oksydacyjnego w komórkach neuronalnych. Recenzje w naukach rolniczych. 2015; 3 : 40–5. [ Google Scholar ]
[82] Kesari KK, Kumar S, Behari J. Promieniowanie mikrofalowe 900 MHz promuje utlenianie w mózgu szczura. Electromagn Biol Med. 2011; 30 : 219–34. [ PubMed ] [ Google Scholar ]
[83] Atli Sekeroglu Z, Akar A, Sekeroglu V. Ocena uszkodzenia cytogenotoksycznego u niedojrzałych i dojrzałych szczurów narażonych na działanie pól elektromagnetycznych o częstotliwości radiowej 900 MHz. Int J Radiat Biol. 2013; 89 : 985–92. [ PubMed ] [ Google Scholar ]
[84] Liu C, Gao P, Xu SC, Wang Y, Chen CH, He MD, et al. Promieniowanie telefonów komórkowych indukuje zależne od trybu uszkodzenia DNA w linii komórkowej pochodzącej ze spermatocytów myszy: ochronna rola melatoniny. Int J Radiat Biol. 2013; 89 : 993–1001. [ PubMed ] [ Google Scholar ]
[85] Ruediger HW. Genotoksyczne skutki pól elektromagnetycznych o częstotliwości radiowej. Patofizjologia. 2009; 16 : 89–102. [ PubMed ] [ Google Scholar ]
[86] Kryston TB, Georgiev AB, Pissis P, Georgakilas AG. Rola stresu oksydacyjnego i uszkodzeń DNA w karcynogenezie człowieka. Mutat Res. 2011; 711 : 193–201. [ PubMed ] [ Google Scholar ]
[87] Henderson PT, Evans MD, Cooke MS. Odzysk utlenionych pochodnych guaniny w puli (2'-deoksy) rybonukleotydów jako źródło mutacji w DNA. Mutat Res. 2010; 703 : 11–7. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[88] Tothova L, Kamodyova N, Cervenka T, Celec P. Ślinowe markery stresu oksydacyjnego w chorobach jamy ustnej. Microbiol Infect Front Cell Infect. 2015; 5 : 73. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[89] Aitken RJ, Harkiss D, Buckingham DW. Analiza mechanizmów peroksydacji lipidów w ludzkich plemnikach. Mol Reprod Dev. 1993; 35 : 302–15. [ PubMed ] [ Google Scholar ]
[90] Agarwal A, Saleh RA. Rola utleniaczy w niepłodności męskiej: uzasadnienie, znaczenie i leczenie. Urol Clin North Am. 2002; 29 : 817–27. [ PubMed ] [ Google Scholar ]
[91] Nelson JF, Karelus K, Bergman MD, Felicio LS. Zaangażowanie neuroendokrynne w starzenie się: dowody z badań nad procesem reprodukcji i ograniczeniem kalorii. Neurobiol Aging. 1995; 16 : 837–43. dyskusja 55-6. [ PubMed ] [ Google Scholar ]
[92] Erogul O, Oztas E, Yildirim I, Kir T, Aydur E, Komesli G, et al. Wpływ promieniowania elektromagnetycznego z telefonu komórkowego na ruchliwość plemników człowieka: badanie in vitro. Arch Med Res. 2006; 37 : 840–3. [ PubMed ] [ Google Scholar ]
[93] Goldhaber MK, Polen MR, Hiatt RA. Ryzyko poronienia i wad wrodzonych u kobiet używających terminali wizualnych w czasie ciąży. Am J Ind Med. 1988; 13 : 695–706. [ PubMed ] [ Google Scholar ]
[94] Forgacs Z, Somosy Z, Kubinyi G, Bakos J, Hudak A, Surjan A, et al. Wpływ ekspozycji całego ciała na działanie mikrofal podobne do GSM 1800 MHz na steroidogenezę jąder i histologię myszy. Reprod Toxicol. 2006; 22 : 111–7. [ PubMed ] [ Google Scholar ]
[95] Ozguner M, Koyu A, Cesur G, Ural M, Ozguner F, Gokcimen A, et al. Biologiczny i morfologiczny wpływ na narząd rozrodczy szczurów po ekspozycji na pole elektromagnetyczne. Saudi Med J. 2005; 26 : 405–10. [ PubMed ] [ Google Scholar ]
[96] Ghodbane SLA, Ammari M, Sakly M, Abdelmelek H. Czy statyczny stres oksydacyjny wywołany ekspozycją na pole magnetyczne i apoptoza w nerkach i mięśniach szczurów. Wpływ suplementacji witaminy E i selenu? Gen Physiol Biophys. 2015; 34 : 23–32. [ PubMed ] [ Google Scholar ]
[97] Meral I, Mert H, Mert N, Deger Y, Yoruk I, Yetkin A, et al. Wpływ pola elektromagnetycznego 900 MHz emitowanego z telefonu komórkowego na stres oksydacyjny mózgu i niektóre poziomy witamin u świnek morskich. Brain Res. 2007; 1169 : 120–4. [ PubMed ] [ Google Scholar ]
[98] Misa-Agustino MJ, Leiro-Vidal JM, Gomez-Amoza JL, Jorge-Mora MT, Jorge-Barreiro FJ, Salas-Sanchez AA, et al. Promieniowanie elektromagnetyczne o częstotliwości 2450 MHz wywołuje zmiany w morfologii i ekspresji białek szoku cieplnego i receptorów glukokortykoidowych w grasicy szczura. Life Sci. 2015; 127 : 1–11. [ PubMed ] [ Google Scholar ]
[99] Balci M, Devrim E, Durak I. Wpływ telefonów komórkowych na równowagę utleniaczy / przeciwutleniaczy w rogówce i soczewce szczurów. Curr Eye Res. 2007; 32 : 21–5. [ PubMed ] [ Google Scholar ]
[100] Bodera P, Stankiewicz W, Zawada K, Antkowiak B, Paluch M, Kieliszek J, et al. Zmiany zdolności antyoksydacyjnej krwi w wyniku wzajemnego działania pola elektromagnetycznego (1800 MHz) i leku opioidowego (tramadolu) w zwierzęcym modelu przetrwałego stanu zapalnego. Pharmacol Rep. 2013; 65 : 421–8. [ PubMed ] [ Google Scholar ]
[101] Ozorak A, Naziroglu M, Celik O, Yuksel M, Ozcelik D, Ozkaya MO, et al. Wi-Fi (2,45 GHz) - i telefon komórkowy (900 i 1800 MHz) - Wywołane ryzyko stresu oksydacyjnego i elementów w nerkach i jądrach szczurów podczas ciąży i rozwoju potomstwa. biol trace elem Res. 2013; 156 : 221–9. [ PubMed ] [ Google Scholar ]
[102] Ozgur E, Guler G, Seyhan N. Uszkodzenia wolnych rodników w wątrobie wywołane przez telefon komórkowy są hamowane przez przeciwutleniacze N-acetylocysteinę i galusan epigallokatechiny. Int J Radiat Biol. 2010; 86 : 935–45. [ PubMed ] [ Google Scholar ]
[103] Ikinci A, Mercantepe T, Unal D, Erol HS, Sahin A, Aslan A, et al. Zaburzenia morfologiczne i przeciwutleniające w rdzeniu kręgowym samców potomstwa szczurów po ekspozycji na ciągłe pole elektromagnetyczne 900 MHz we wczesnym i środkowym okresie dojrzewania. J Chem Neuroanat. 2016; 75 : 99–104. [ PubMed ] [ Google Scholar ]
[104] Gurler HS, Bilgici B, Akar AK, Tomak L, Bedir A. Zwiększone utlenianie DNA (8-OHdG) i białek (AOPP) przez pole elektromagnetyczne o niskim poziomie (2,45 GHz) w mózgu szczura i ochronne działanie czosnku. Int J Radiat. Biol. 2014; 90 : 892–6. [ PubMed ] [ Google Scholar ]
[105] Turedi S, Kerimoglu G, Mercantepe T, Odaci E. Biochemiczne i patologiczne zmiany w nerkach i pęcherzu samców szczurów po ekspozycji na ciągłe pole elektromagnetyczne 900 MHz w dniach 22–59 po urodzeniu. Int J Radiat Biol. 2017: 1–10. [ PubMed ] [ Google Scholar ]
[106] Yan JG, Agresti M, Bruce T, Yan YH, Granlund A, Matloub HS. Wpływ emisji z telefonów komórkowych na ruchliwość plemników u szczurów. Fertil Steril. 2007; 88 : 957–64. [ PubMed ] [ Google Scholar ]
[107] Rajkovic V, Matavulj M, Gledic D, Lazetic B. Ocena stanu morfofizjologicznego gruczołu tarczowego szczura po trzymiesięcznej ekspozycji na pole elektromagnetyczne 50 Hz. Tissue Cell. 2003; 35 : 223–31. [ PubMed ] [ Google Scholar ]
[108] Deniz OG, Kivrak EG, Kaplan AA, Altunkaynak BZ. Wpływ kwasu foliowego na nerki szczura narażone na promieniowanie elektromagnetyczne 900 MHz. JMAU. 2017: 900. w prasie. [ Google Scholar ]
[109] Wang XW, Ding GR, Shi CH, Zhao T, Zhang J, Zeng LH, et al. Wpływ ekspozycji na impuls elektromagnetyczny na przepuszczalność bariery krew-jądro u myszy. Biomed Environ Sci. 2008; 21 : 218–21. [ PubMed ] [ Google Scholar ]
[110] Avendano C, Mata A, Sarmiento CAS, Doncel GF. Korzystanie z laptopów podłączonych do Internetu przez Wi-Fi zmniejsza ruchliwość ludzkich plemników i zwiększa fragmentację DNA plemników. Fertil Steril. 2012; 97 : 39 – U93. [ PubMed ] [ Google Scholar ]
[111] Narayanan SN, Kumar RS, Kedage V, Nalini K, Nayak S, Bhat PG. Ocena stresu oksydacyjnego i obrony przeciwutleniającej w oddzielnych obszarach mózgu szczurów narażonych na promieniowanie 900 MHz. Bratisl Med J. 2014; 115 : 260–6. [ Google Scholar ]
[112] Hanci H, Türedi S, Topal Z, Mercantepe T, Bozkurt I, Kaya H, et al. Czy prenatalna ekspozycja na pole elektromagnetyczne 900 MHz może wpływać na morfologię śledziony i grasicy oraz zmieniać biomarkery uszkodzeń oksydacyjnych u 21-dniowych samców szczurów? Biotech Histochem. 2015; 90 : 535–43. [ PubMed ] [ Google Scholar ]
[113] Lantow M, Lupke M, Frahm J, Mattsson MO, Kuster N, Simko M. ROS release i ekspresja Hsp70 po ekspozycji na pola elektromagnetyczne o częstotliwości radiowej 1800 MHz w pierwotnych ludzkich monocytach i limfocytach. Radiat Environ Biophys. 2006; 45 : 55–62. [ PubMed ] [ Google Scholar ]
[114] Baohong W, Lifen J, Lanjuan L, Jianlin L, Deqiang L, Wei Z, et al. Ocena łącznego wpływu na uszkodzenie DNA ludzkich limfocytów wywołane promieniowaniem ultrafioletowym C i mikrofalami 1,8 GHz przy użyciu testu kometowego in vitro. Toksykologia. 2007; 232 : 311–6. [ PubMed ] [ Google Scholar ]
[115] Ansarihadipour H, Bayatiani M. Wpływ pól elektromagnetycznych na toksyczność ołowiu: badanie zmian konformacyjnych w białkach krwi ludzkiej. Iran Red Crescent Med J. 2016; 18 : e28050. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[116] Belyaev IY, Hillert L, Protopopova M, Tamm C, Malmgren LO, Persson BR, et al. Mikrofale 915 MHz i pole magnetyczne 50 Hz wpływają na konformację chromatyny i ogniska 53BP1 w ludzkich limfocytach u osób nadwrażliwych i zdrowych. Bioelektromagnetyka. 2005; 26 : 173–84. [ PubMed ] [ Google Scholar ]
[117] Agarwal A, Desai NR, Makker K, Varghese A, Mouradi R, Sabanegh E, et al. Wpływ fal elektromagnetycznych o częstotliwości radiowej (RF-EMW) z telefonów komórkowych na spermę z wytryskiem człowieka: badanie pilotażowe in vitro. Fertil Steril. 2009; 92 : 1318–25. [ PubMed ] [ Google Scholar ]
[118] Lewicka M, Henrykowska GA, Pacholski K, Smigielski J, Rutkowski M, Dziedziczak-Buczyńska M, et al. Wpływ promieniowania elektromagnetycznego emitowanego przez ekrany na metabolizm tlenu w komórce - badania in vitro. Arch Med Sci. 2015; 11 : 1330–9. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[119] Lu YS, Huang BT, Huang YX. Tworzenie reaktywnych form tlenu i apoptoza w komórkach jednojądrzastych ludzkiej krwi obwodowej wywołane promieniowaniem telefonu komórkowego 900 MHz. Oxid Med Celi Longev. 2012; 2012 : 740280. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[120] De Iuliis GN, Newey RJ, King BV, Aitken RJ. Promieniowanie telefonów komórkowych indukuje produkcję reaktywnych form tlenu i uszkodzenia DNA w ludzkich plemnikach in vitro. PLoS One. 2009; 4 : e6446. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[121] Sefidbakht Y, Moosavi-Movahedi AA, Hosseinkhani S, Khodagholi F, Torkzadeh-Mahani M, Foolad F, et al. Wpływ 940 MHz EMF na bioluminescencję i odpowiedź oksydacyjną stabilnych komórek HEK wytwarzających lucyferazę. Photochem Photobiol Sci. 2014; 13 : 1082–92. [ PubMed ] [ Google Scholar ]
[122] Goraca A, Ciejka E, Piechota A. Wpływ skrajnie niskiej częstotliwości pola magnetycznego na parametry stresu oksydacyjnego w sercu. J Physiol Pharmacol. 2010; 61 : 333–8. [ PubMed ] [ Google Scholar ]
[123] Halliwell B. Jak scharakteryzować przeciwutleniacz - aktualizacja. Biochem Soc Symp. 1995; 61 : 73–101. [ PubMed ] [ Google Scholar ]
[124] Rice-Evans CA, Diplock AT. Aktualny stan terapii antyoksydacyjnej. Bezpłatny Radic Biol Med. 1993; 15 : 77–96. [ PubMed ] [ Google Scholar ]
[125] Krinsky NI. Mechanizm działania biologicznych przeciwutleniaczy. Proc Soc Exp Biol Med. 1992; 200 : 248–54. [ PubMed ] [ Google Scholar ]
[126] Di Loreto S, Falone S, Caracciolo V, Sebastiani P, D'Alessandro A, Mirabilio A, et al. Ekspozycja na pole magnetyczne o skrajnie niskiej częstotliwości 50 Hz wywołuje reakcję redoks i troficzną w neuronach korowych szczurów. J Celi Physiol. 2009; 219 : 334–43. [ PubMed ] [ Google Scholar ]
[127] Sun W, Gan Y, Fu Y, Lu D, Chiang H. Niespójne pole magnetyczne hamowało gromadzenie się receptorów EGF i fosforylację indukowaną przez pole magnetyczne 50 Hz w hodowanych komórkach FL. Cell Physiol Biochem. 2008; 22 : 507–14. [ PubMed ] [ Google Scholar ]
[128] PL Ochrona antyoksydacyjna w komórkach eukariotycznych. Bazylea, Szwajcaria: Birkhauser Verlag; 1993. [ Google Scholar ]
[129] Zhao X, Alexander JS, Zhang S, Zhu Y, Sieber NJ, Aw TY, i wsp. Regulacja redoks integralności bariery śródbłonkowej. Am J Physiol Lung Cell Mol Physiol. 2001; 281 : L879–86. [ PubMed ] [ Google Scholar ]
[130] Aslan L, Meral I. Wpływ doustnej suplementacji witaminy E na stres oksydacyjny u świnek morskich z krótkotrwałą hipotermią. Cell Biochem Funct. 2007; 25 : 711–5. [ PubMed ] [ Google Scholar ]
[131] Awad SM, Hassan NS. Zagrożenia zdrowotne związane z promieniowaniem elektromagnetycznym z telefonu komórkowego na mózg szczurów. Journal of Applied Sciences Research. 2008; 4 : 1994–2000. [ Google Scholar ]
[132] Luo X, Chen M, Duan Y, Duan W, Zhang H, He Y, i wsp. Chemoprotekcyjne działanie procyjanidyn nasion lotosu na stres oksydacyjny u myszy wywołany ekspozycją na pole elektromagnetyczne o ekstremalnie niskiej częstotliwości. Biomed Pharmacother. 2016; 82 : 640–8. [ PubMed ] [ Google Scholar ]
[133] Singh HP, Sharma VP, Batish DR, Kohli RK. Promieniowanie pola elektromagnetycznego telefonu komórkowego wpływa na rizogenezę poprzez upośledzenie procesów biochemicznych. Ocena monitorowania środowiska. 2012; 184 : 1813–21. [ PubMed ] [ Google Scholar ]
[134] Sepehrimanesh M, Nazifi S, Saeb M, Kazemipour N. Wpływ ekspozycji na pole elektromagnetyczne o częstotliwości radiowej 900 MHz na surowicę i tkankę jąder antyoksydenzymów szczura. Internetowy dziennik badań weterynaryjnych. 2016; 20 (9): 617–24. [ Google Scholar ]
[135] Tkalec M, Stambuk A, Srut M, Malaric K, Klobucar GI. Działanie oksydacyjne i genotoksyczne pól elektromagnetycznych 900 MHz u dżdżownicy Eisenia fetida. Ecotoxicol Environ Saf. 2013; 90 : 7–12. [ PubMed ] [ Google Scholar ]
[136] Lanir A, Schejter A. Na szóstej pozycji koordynacyjnej katalazy wątroby wołowej. Febs Lett. 1975; 55 : 254–6. [ PubMed ] [ Google Scholar ]
[137] Ozturk A, Baltaci AK, Mogulkoc R, Oztekin E. Cynkowe zapobieganie uszkodzeniom jąder i nerek szczurów wywołanym elektromagnetycznie. Biol Trace Elem Res. 2003; 96 : 247–54. [ PubMed ] [ Google Scholar ]
[138] Martinez-Samano JTP, Rez-Oropeza MA, Elias-Vinas D, Verdugo-Díaz L. Wpływ ostrej ekspozycji na pole elektromagnetyczne i ograniczenia ruchu na układ przeciwutleniający w wątrobie, sercu, nerkach i osoczu szczurów Wistar: raport wstępny . Int J Radiat Biol. 2010; 86 : 1088–94. [ PubMed ] [ Google Scholar ]
[139] Devrim E, Ergüder I, Kiliçoglu B, Yaykasli E, Cetin R, Durak I. od szczurów: możliwa ochronna rola witaminy C. Toxicol Mech Methods. 2008; 18 : 679 6–83. [ PubMed ] [ Google Scholar ]
[140] Odaci E, Unal D, Mercantepe T, Topal Z, Hanci H, Turedi S, et al. Patologiczne skutki prenatalnej ekspozycji na pole elektromagnetyczne 900 MHz na nerkę 21-dniowego samca szczura. Biotech Histochem. 2015; 90 : 93–101. [ PubMed ] [ Google Scholar ]
[141] Kinnula VL, Paakko P, Soini Y. Enzymy przeciwutleniające i regulujące redoks białka tiolowe w chorobach nowotworowych ludzkiego płuca. FEBS Lett. 2004; 569 : 1–6. [ PubMed ] [ Google Scholar ]
[142] Sokolovic D, Djindjic B, Nikolic J, Bjelakovic G, Pavlovic D, Kocic G, et al. Melatonina zmniejsza stres oksydacyjny wywołany przewlekłą ekspozycją na promieniowanie mikrofalowe z telefonów komórkowych w mózgu szczura. J Radiat Res. 2008; 49 : 579–86. [ PubMed ] [ Google Scholar ]
[143] Ozguner F, Oktem F, Ayata A, Koyu A, Yilmaz HR. Nowy środek przeciwutleniający, ester fenetylowy kwasu kawowego, zapobiega długotrwałym zaburzeniom czynności nerek wywołanym narażeniem na telefon komórkowy u szczurów. Wartość prognostyczna dialdehydu malonowego. Oznaczanie N-acetylo-beta-D-glukozaminidazy i tlenku azotu. Mol Celi Biochem. 2005; 277 : 73–80. [ PubMed ] [ Google Scholar ]
[144] Fang YZ, Yang S, Wu GY. Wolne rodniki, przeciwutleniacze i odżywianie. Odżywianie. 2002; 18 : 872–9. [ PubMed ] [ Google Scholar ]
[145] Martinez-Samano J, Torres-Duran PV, Juarez-Oropeza MA, Verdugo-Diaz L. Arch Med Res. 2012; 43 : 183–9. [ PubMed ] [ Google Scholar ]
[146] Ghanbari AA, Shabani K, Mohammad nejad D. efekt ochronny spożycia witaminy e przed wpływem pola elektromagnetycznego 3MT na parametry oksydacyjne w istocie czarnej u szczurów. Basic Clin Neurosci. 2016; 7 : 315–22. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[147] de Moffarts B, Kirschvink N, Art T, Pincemail J, Lekeux P. Wpływ doustnej suplementacji przeciwutleniaczem na status antyoksydacyjny krwi u wytrenowanych koni pełnej krwi. Vet J. 2005; 169 : 65–74. [ PubMed ] [ Google Scholar ]
[148] Ulubay M, Yahyazadeh A, Deniz OG, Kivrak EG, Altunkaynak BZ, Erdem G, et al. Wpływ ekspozycji na pole elektromagnetyczne 900 MHz w okresie prenatalnym na histologię nerek szczurów. Int J Radiat Biol. 2015; 91 : 35–41. [ PubMed ] [ Google Scholar ]
[149] Ralston NVC, Ralston CR, Blackwell JL, Raymond LJ. Selen pokarmowy i tkankowy a toksyczność metylortęci. Neurotoksykologia. 2008; 29 : 802–11. [ PubMed ] [ Google Scholar ]
[150] Zhang J, Zhang YH, Jiang RP, Lian ZS, Wang H, Luo R i wsp. Ochronne działanie witaminy E przed promieniowaniem elektromagnetycznym z telefonów komórkowych w tkankach mózgowych ciężarnych i płodowych szczurów. Journal of Shandong University (nauki o zdrowiu) 2011; 9 : 9–14. [ Google
Scholar ]
[151] Doustnie B, Guney M, Ozguner F, Karahan N, Mungan T, Comlekci S, et al. Apoptoza endometrium wywołana telefonem komórkowym 900 MHz: profilaktyczne działanie witamin E i C. Adv Ther. 2006; 23 : 957–73. [ PubMed ] [ Google Scholar ]
[152] Mohammadnejad D, Rad JS, Azami A, Lotfi A. Rola witaminy E w zapobieganiu uszkodzeniom grasicy wywołanym polem elektromagnetycznym: badania ultrastrukturalne i mikroskopowe. Biuletyn Instytutu Weterynarii w Puławach. 2011; 55 : 111–5. [ Google Scholar ]
[153] Traber MG. Mechanizmy regulacyjne witaminy E. Annu Rev Nutr. 2007; 27 : 347–62. [ PubMed ] [ Google Scholar ]
[154] Wang X, Fenech M. Porównanie kwasu foliowego i 5-metylotetrahydrofolianu w zapobieganiu uszkodzeniom DNA i śmierci komórek w ludzkich limfocytach in vitro. Mutageneza. 2003; 18 : 81–6. [ PubMed ] [ Google Scholar ]
[155] Hardeland R, Pandi-Perumal SR, Cardinali DP. Melatonina. Int J Biochem Celi Biol. 2006; 38 : 313–6. [ PubMed ] [ Google Scholar ]
[156] Hardeland R. Ochrona antyoksydacyjna melatoniną: różnorodność mechanizmów od radykalnej detoksykacji do unikania rodników. Wewnątrzwydzielniczy. 2005; 27 : 119–30. [ PubMed ] [ Google Scholar ]
[157] Tan DX, Poeggeler B, Manchester LC, Reiter RJ. Melatonina: silny, endogenny zmiatacz rodników hydroksylowych. Endocrine J. 1993; 1 : 57–60. [ Google Scholar ]
[158] DAWN Lowes, Murphy MP, Galley HF. Przeciwutleniacze, które chronią mitochondria, redukują interleukinę-6 i stres oksydacyjny, poprawiają funkcje mitochondriów i redukują biochemiczne markery dysfunkcji narządów w szczurzym modelu ostrej posocznicy. Anaesth. 2013; 110 : 472–80. [ Bezpłatny artykuł PMC ] [ PubMed ] [ Google Scholar ]
[159] Reiter RJ, Herman TS, Meltz ML. Melatonina i ochrona przed promieniowaniem przed uszkodzeniem genetycznym: badania in vivo / in vitro z udziałem ochotników. Mutat Res. 1996; 371 : 221–8. [ PubMed ] [ Google Scholar ]
[160] Reiter RJ, Herman TS, Meltz ML. Melatonina zmniejsza pierwotne uszkodzenie DNA w limfocytach krwi ludzkiej wywołane promieniowaniem gamma. Mutat Res. 1998; 397 : 203–8. [ PubMed ] [ Google Scholar ]
[161] Shirazi A, Ghobadi G, Ghazi-Khansari M. A radiobiological review onmelatonin: a new radioprotector. J Radiat Res. 2007; 48 : 263–72. [ PubMed ] [ Google Scholar ]
[162] Ozguner F, Aydin G, Mollaoglu H, Gokalp O, Koyu A, Cesur G. Zapobieganie zmianom tkanki skóry wywołanym telefonem komórkowym przez melatoninę u szczurów: badanie eksperymentalne. Toxicol Ind Health. 2004; 20 : 133–9. [ PubMed ] [ Google Scholar ]
Źródło:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6025786/