Tomasz P. Wypych , Benjamin J. Marsland , and Niki D. J. Ubags -Author Affiliations
Faculty of Biology and Medicine, University of Lausanne, Service de Pneumologie, Centre Hospitalier Universitaire Vaudois, Epalinges, SwitzerlandCorresponding Author: Benjamin J. Marsland
Received: March 21, 2017Accepted: July 11, 2017
Skrót:
Świat zachodni był świadkiem ogromnego wzrostu występowania alergii i autoimmunizacji w drugiej połowie XX wieku.
Podjęto wiele wysiłków, aby wyjaśnić to zjawisko i sformułowano różne hipotezy.
Wśród nich największą uwagę zwróciły dwie koncepcje: „hipoteza higieniczna”, wskazująca na zmniejszenie narażenia na mikroorganizmy środowiskowe jako siłę napędową obserwowanych trendów epidemiologicznych;
oraz „hipotezy dietetyczne”, wskazujące na znaczenie zmian w naszych nawykach żywieniowych.
W tym przeglądzie omawiamy wzajemne oddziaływanie między zachodnią dietą, mikrobiotą i stanami zapalnymi, ze szczególnym uwzględnieniem chorób układu oddechowego.
Następnie pokazujemy dogłębny przegląd potencjału immunomodulacyjnego różnych kwasów tłuszczowych w diecie.
Kończymy, wskazując na nierozstrzygnięte pytania, na które odpowiedź mogłaby rzucić więcej światła na wpływ nawyków żywieniowych na odporność i powiązać ją z postulatami stawianymi przez hipotezę higieniczną.
Połączenie tych dwóch koncepcji będzie ważnym krokiem w kierunku zrozumienia, w jaki sposób zachodni styl życia kształtuje podatność na choroby.
W ciągu ostatnich kilku dziesięcioleci nawyki żywieniowe uległy ogromnym zmianom (1) i obecnie rośnie świadomość wpływu, jaki wywarło to na nasz układ odpornościowy, a co za tym idzie na zdrowie i choroby.
W świecie zachodnim zaobserwowano zwiększone spożycie wysokoenergetycznej i przetworzonej żywności, często nazywanej „zachodnią dietą”.
Ta dieta jest ogólnie bogata w białko zwierzęce, strawne cukry, skrobię i tłuszcz, podczas gdy zawartość błonnika pokarmowego jest niska (1).
Obserwowana zmiana żywieniowa w świecie zachodnim zbiegła się ze wzrostem częstości występowania
chorób zapalnych (w tym astmy i alergii) i autoimmunologicznych (2, 3).
Składniki diety są głównymi determinantami składu drobnoustrojów jelitowych i w konsekwencji mogą kształtować charakterystykę odpowiedzi immunologicznej.
W tym artykule omawiamy wpływ zachodniej diety na mikrobiom jelitowy i jego wpływ na zdrowie i
choroby płuc.
W szczególności podkreśla się wpływ kwasów tłuszczowych na odpowiedzi immunologiczne i ich potencjalne konsekwencje dla zdrowia układu oddechowego.
Zmiany nawyków żywieniowych, takie jak spożywanie bardziej „zachodniej diety”, są ważnym czynnikiem przyczyniającym się do globalnej epidemii otyłości.
Otyłość jest w najszerszym znaczeniu wynikiem braku równowagi między spożyciem energii a wydatkiem energetycznym.
Ta nadwyżka składników odżywczych i metabolicznych wyzwala przewlekłą ogólnoustrojową odpowiedź zapalną o niskim stopniu nasilenia i angażuje zestaw cząsteczek i szlaków sygnałowych podobnych do tych zaangażowanych w klasyczne zapalenie (4).
Jednak ogólnoustrojowe zapalenie wywołane otyłością różni się od klasycznego zapalenia w kilku kluczowych aspektach.
Otyłość jest chorobą przewlekłą i powoduje łagodną aktywację wrodzonego układu odpornościowego.
Ponadto nawracające zmiany poposiłkowej ilości składników odżywczych prowadzą do wahań w krążących składnikach metabolicznych (np. triacyloglicerole, lipidy, wolne kwasy tłuszczowe i glukoza), które indukują aktywację immunologiczną (5–7).
Na strukturę i funkcję mikroflory jelitowej silnie wpływają również zmiany nawyków żywieniowych, które w konsekwencji mogą zmienić odpowiedzi immunologiczne.
Tutaj przyjrzymy się, jak wysokie spożycie tłuszczu i niskie spożycie błonnika pokarmowego, widoczne w diecie zachodniej, zmienia mikrobiom jelitowy i może wpływać na zdrowie i choroby płuc (ryc. 1).
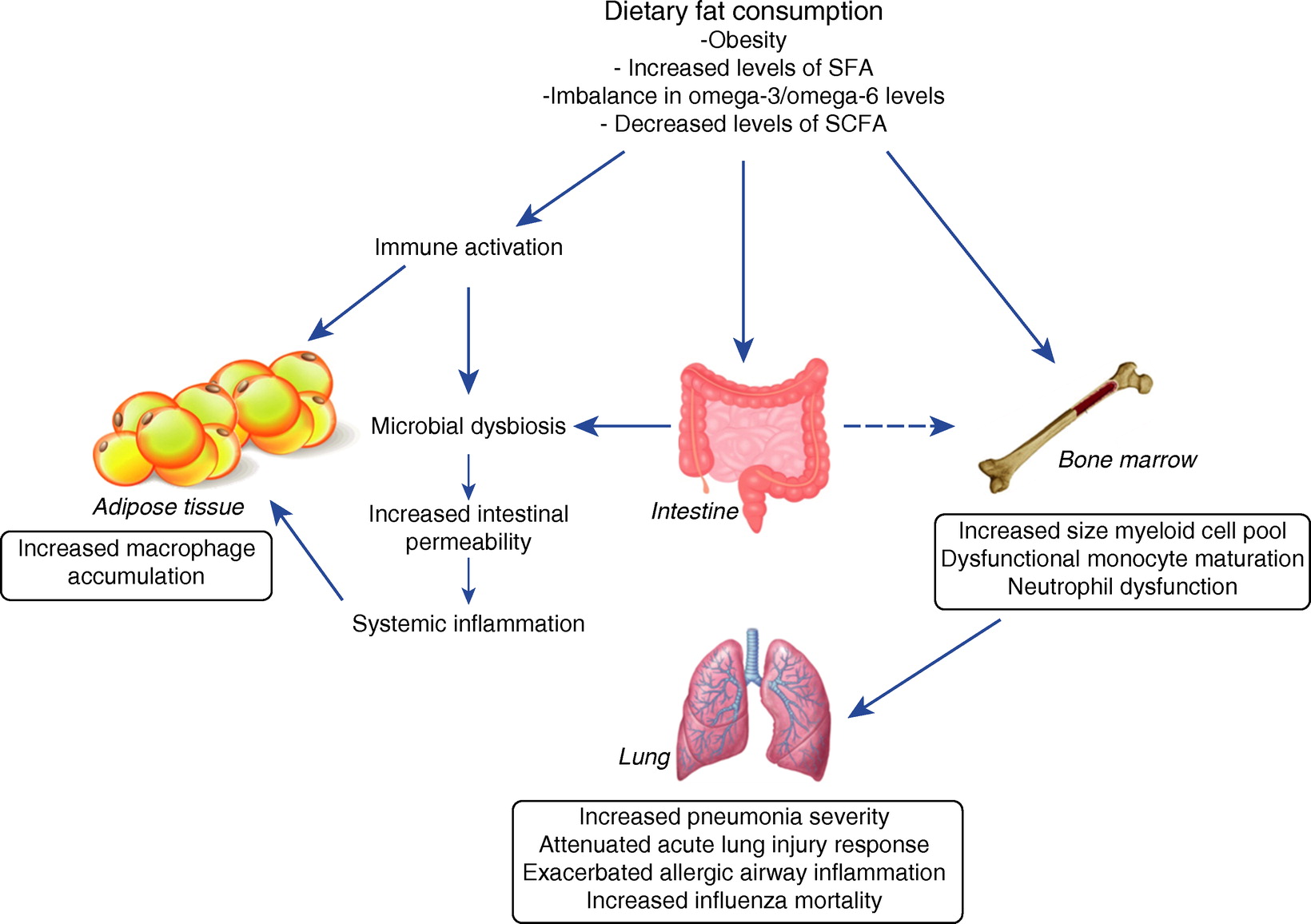 Rysunek 1.
Rysunek 1.
Immunomodulacyjne skutki spożycia tłuszczów - na choroby płuc.
Zwiększone spożycie tłuszczu w diecie wiąże się z ogólnoustrojowym stanem zapalnym, które może prowadzić do aktywacji immunologicznej w powiązanych tkankach, takich jak tkanka tłuszczowa.
Efekt ten może wynikać z indukcji otyłości - lub z bezpośrednich zmian w równowadze kwasów tłuszczowych.
Zapalenie tkanki tłuszczowej może charakteryzować się zwiększoną akumulacją makrofagów i tworzeniem się tzw. „
Struktur przypominających korony”.
(
Podkreślam, że to praca z 2017 roku, a wspomniane są "struktury przypominające korony" (!))
Ogólnoustrojowe zapalenie i aktywacja immunologiczna mogą zmieniać skład drobnoustrojów w jelicie, prowadząc do dysbiozy.
Dysbioza jelit może zwiększyć przepuszczalność jelit, umożliwiając w ten sposób przemieszczanie się bakterii do układu krążenia (i prawdopodobnie tkanki tłuszczowej) i nasilenie ogólnoustrojowego stanu zapalnego, co z kolei może prowadzić do zapalenia tkanki tłuszczowej.
Złożoność mikrobioty jelitowej jest silnie skorelowana z wielkością puli szpiku kostnego.
Ponadto otyłość wywołana dietą wysokotłuszczową może zmienić pulę komórek szpikowych;
jednakże, czy istnieje bezpośredni związek między spożyciem diety wysokotłuszczowej, mikroflorą jelitową i wielkością puli komórek szpikowych pozostaje do potwierdzenia.
Otyłość wywołana dietą została powiązana z dysfunkcyjnym dojrzewaniem monocytów i dysfunkcją neutrofili w szpiku kostnym.
W badaniach na myszach wiązało się to ze zwiększonym nasileniem zapalenia płuc i osłabieniem przez ostre uszkodzenia płuc.
SCFA = krótkołańcuchowe kwasy tłuszczowe;
SFA = nasycone kwasy tłuszczowe.
Spożycie tłuszczu w diecie i zapalenie ogólnoustrojowe
Zmiany w diecie, a następnie modulacja odporności gospodarza i ekologii drobnoustrojów mogą zmieniać homeostazę drobnoustrojów gospodarza, prowadząc do dysbiozy jelit.
Zrównoważona społeczność drobnoustrojów w jelicie jest niezbędna dla prawidłowego funkcjonowania układu odpornościowego i zdrowia, ponieważ dysbioza mikrobiomu jelitowego wiąże się zarówno z miejscowymi, jak i przewlekłymi zaburzeniami ogólnoustrojowymi (8–10).
Wykazano, że spożycie w diecie wysokotłuszczowej zmienia skład drobnoustrojów w jelicie poprzez zwiększenie stosunku Firmicutes do Bacteroidetes (11, 12).
To przesunięcie jest związane ze zwiększoną przepuszczalnością jelit i zwiększonymi poziomami krążącego LPS, co może wywoływać ogólnoustrojowe zapalenie (13, 14).
Co ciekawe, rodzaj tłuszczu w diecie (smalec lub olej rybny) stosowany w diecie wysokotłuszczowej wywołuje różne zmiany w mikrobiomie jelitowym myszy, co w konsekwencji prowadzi do zróżnicowanej aktywacji odpowiedzi immunologicznej (15).
Na przykład myszy karmione dietą wysokotłuszczową opartą na smalcu wykazywały zwiększoną aktywację receptora Toll-like (TLR) w krążeniu ogólnoustrojowym, zwiększoną strukturę przypominającą korony i akumulację komórek CD45 + w białej tkance tłuszczowej, co wskazuje na zwiększoną białość zapalenie tkanki tłuszczowej (15).
Ponadto zmiany mikrobioty jelit wywołane dietą wysokotłuszczową zostały powiązane z nadmierną ekspansją bakterii wytwarzających endotoksyny, zwiększając w ten sposób przepuszczalność jelit (13) i sprzyjając translokacji żywych bakterii Gram-ujemnych przez błonę śluzową jelit do układu krążenia i krezkowej tkanki tłuszczowej. (16).
Oprócz zmian mikrobiologicznych zależnych od diety, zmiany wrodzonej odporności, bezpośrednio spowodowane składnikami diety, są również zdolne do kształtowania mikrobioty komensalnej.
Na przykład wzorce molekularne związane z patogenami i wzorce molekularne związane z niebezpieczeństwem pochodzące z mikroflory jelitowej i czynników dietetycznych (np. kwasy tłuszczowe, ceramidy, białko box 1 grupy o wysokiej ruchliwości, fetuina, białka szoku cieplnego i zmodyfikowana lipoproteina o niskiej gęstości) zaproponowano aktywację TLR podczas rozwoju otyłości (17).
Ponadto sugeruje się, że karmienie dietą wysokotłuszczową zmniejsza poziom maślanu w krwiobiegu u myszy (18);
jednak konieczne są dodatkowe badania, aby określić, czy ma to wpływ na aktywację immunologiczną.
Spożycie tłuszczu w diecie, modulacja odporności i choroby układu oddechowego
Badania kliniczne określające wpływ spożycia tłuszczów w diecie na modulację odporności wykazały, że prowokacja wysokotłuszczowym posiłkiem u zdrowych osób zwiększa poziom krążących cytokin prozapalnych i neutrofili (7, 19, 20).
Opisano konsekwencje dla zdrowia i chorób płuc.
Wood i wsp. zaobserwowali wzrost zarówno ekspresji TLR4 na komórkach indukowanej plwociny, jak i liczby neutrofili w plwocinie osób z astmą - karmionych posiłkiem bogatym w tłuszcze (21).
Profilowanie ekspresji genów w komórkach plwociny u osób zdrowych i chorych na astmę karmionych dietą wysokotłuszczową ujawniło zwiększoną ekspresję genów reprezentujących procesy układu odpornościowego (np. genów kodujących białko P wiążące wapń S100, białko A16 wiążące wapń S100, mielinę i limfocyty białko i mucyna 1) u osób z astmą (22).
Dane te sugerują, że w odpowiedzi zapalnej dróg oddechowych wywołanej dietą wysokotłuszczową u osób z astmą zaangażowanych jest wiele szlaków odpornościowych.
Jednak dodatkowe badania mechanistyczne są uzasadnione w celu określenia mechanizmów molekularnych leżących u podstaw tego zjawiska.
Badania na myszach stosujących dietę wysokotłuszczową i związaną z tym otyłość ujawniły zmiany w odpowiedzi immunologicznej związane z rozwojem i stanem zapalnym.
Żywienie myszy dietą wysokotłuszczową wywołuje niewielkie zmiany w składzie szpiku kostnego.
Nieznaczny wzrost odsetka limfocytów obserwuje się po przewlekłym żywieniu dietą wysokotłuszczową (od 90 dnia).
Jednak 40% wzrost całkowitej ilości komórek jądrzastych zaobserwowano u myszy z otyłością indukowaną dietą w porównaniu z grupą kontrolną stosującą dietę niskotłuszczową, co sugeruje ogólny wzrost hematopoezy (23).
Ponadto wykazano, że wielkość puli komórek szpikowych szpiku kostnego silnie koreluje ze złożonością mikroflory jelitowej (24).
Zmiany w składzie mikroflory, obserwowane w otyłości, mogą zatem wpływać na wzajemne oddziaływanie między hematopoezą a mikrobiotą i potencjalnie zaostrzać stan zapalny lub infekcję u żywiciela.
Dowody sugerują, że otyłość będąca konsekwencją żywienia dietą wysokotłuszczową może prowadzić do dysfunkcji limfocytów T i makrofagów.
W szczególności zmniejszona ekspresja cytokin w odpowiedzi na infekcję, obserwowana u otyłych myszy wywołanych dietą, jest powiązana z dysfunkcją makrofagów szpiku kostnego i / lub zaburzeniem dojrzewania monocytów i obniżeniem ekspresji TLR2 na tych komórkach (25).
Ponadto wykazano wywołane dietą wady rozwoju i odpowiedzi czynnościowe neutrofili pochodzących ze szpiku kostnego wywołane otyłością, co prowadzi do osłabienia odpowiedzi zapalnej płuc po wywołaniu ostrego uszkodzenia płuc (26), podczas gdy nasilenie bakteryjnego zapalenia płuc jest zwiększone. (27)
Spożycie błonnika pokarmowego
Błonnik to ważny składnik naszej diety.
W typowej „diecie zachodniej” zawartość błonnika pokarmowego jest niska (37).
Wzrosło zainteresowanie potencjalnymi korzystnymi skutkami diety bogatej w błonnik.
Błonnik pokarmowy jest substratem dla drobnoustrojów jelitowych (38), a niskie spożycie błonnika prowadzi do obniżenia poziomu krótkołańcuchowych kwasów tłuszczowych (SCFA).
Analiza bazy danych NHANES (National Health and Nutrition Examination Survey), bazy danych oceniającej stan zdrowia i odżywienia dorosłych i dzieci w Stanach Zjednoczonych, ujawniła związek między niskim spożyciem błonnika a dolną czynnością płuc (39) oraz zwiększoną dietą
spożycie błonnika wiąże się z 40–50% spadkiem liczby zgonów związanych z oddychaniem (40, 41).
Co więcej, jedno badanie wykazało, że spożycie rozpuszczalnego posiłku zawierającego błonnik zmniejsza stan zapalny dróg oddechowych (plwocina) i poprawia czynność płuc u osób z astmą (42).
Wykazano, że karmienie myszy dietą bez błonnika sprzyja ekspansji i aktywności bakterii rozkładających śluz w okrężnicy, prowadząc do zwiększonej podatności na infekcje w porównaniu z kontrolami karmionymi błonnikiem (43).
Natomiast wysokiemu spożyciu błonnika pokarmowego i związanemu z nim wzrostowi poziomów SCFA towarzyszą zmiany w składzie drobnoustrojów (podwyższony stosunek Bacteroidetes do Firmicutes) w jelicie (44, 45) i drogach oddechowych (44).
Wszystkie te badania sugerują, że
spożycie błonnika pokarmowego ma duże znaczenie dla zdrowia płuc.
Korzystny wpływ diety bogatej w błonnik na inne reakcje zapalne wykazano w różnych modelach zwierzęcych, w tym w zapaleniu okrężnicy (46), alergicznym zapaleniu dróg oddechowych (44, 45) i alergii pokarmowej (47). były również mediowane przez zmiany poziomów SCFA.
Podstawy dietetyczne chorób zapalnych można przynajmniej częściowo wyjaśnić interakcjami między składnikami diety a komórkami odpornościowymi.
Dietetyczne kwasy tłuszczowe mogą różnić się długością (krótko-, średnio- i długołańcuchowa), poziomem nasycenia (nasycone i nienasycone), oraz ich konformacją, a zatem mogą mieć wyraźnie kontrastujące funkcje.
Poniżej omawiamy różne rodzaje kwasów tłuszczowych i ich wpływ na odpowiedzi immunologiczne i choroby układu oddechowego.
Dieta wysokotłuszczowa, dietetyczne kwasy tłuszczowe i podatność na choroby
Dieta zachodnia charakteryzuje się zwiększoną zawartością tłuszczu w jedzeniu.
Dlatego od dawna wysuwano hipotezę, że większe spożycie tłuszczu może wiązać się ze zwiększonym ryzykiem „chorób cywilizacyjnych”.
Jak omówiono w poprzedniej sekcji, ważnym czynnikiem przyczyniającym się do tego jest otyłość.
Alternatywnie można spekulować, że dieta wysokotłuszczowa zwiększa podatność na choroby niezależnie od otyłości.
Z tego punktu widzenia zwiększone uwalnianie wolnych kwasów tłuszczowych z samej diety skutkowałoby modulacją układu odpornościowego i wpłynęłoby na ryzyko rozwoju choroby.
Wpływ posiłków wysokotłuszczowych na reakcje zapalne, niezależnie od otyłości, oceniano w badaniach z udziałem ludzi.
W pracy Wooda i współpracowników zdrowi pacjenci z astmą otrzymywali wysokotłuszczowy - lub niskotłuszczowy posiłek, a ich czynność płuc i markery zapalenia dróg oddechowych oceniano 4 godziny później.
Co ciekawe, pacjenci, którzy otrzymali wysokotłuszczowy posiłek, mieli zwiększoną ekspresję mRNA TLR4 w swoich komórkach plwociny, co zbiegło się z większą liczbą neutrofili (21).
W badaniu Nappo i wsp. zdrowi ochotnicy otrzymujący posiłek o dużej zawartości tłuszczu mieli podwyższone poziomy cytokin prozapalnych w osoczu (czynnik martwicy nowotworu [TNF] -α i IL-6), a także cząsteczki adhezyjne (cząsteczka adhezji międzykomórkowej 1 i naczyniowa cząsteczka adhezyjna komórek 1), 2–4 godziny po posiłku (19).
Podobnie Blackburn i współpracownicy donosili o podwyższonym poziomie IL-6 w osoczu (7), a van Oostrom i współpracownicy odnotowali wzrost stężenia IL-6 i IL-8 w osoczu wraz ze zwiększoną liczbą neutrofili we krwi u osób otrzymujących posiłek o dużej zawartości tłuszczu ( 20).
Dokładne mechanizmy prowadzące do tych zmian są niejasne, chociaż niektórzy autorzy sugerowali możliwą rolę w zwiększeniu stężenia glukozy i kwasów tłuszczowych.
Ten ostatni mógłby działać na TLR4 i stymulować wrodzone komórki odpornościowe do produkcji cytokin prozapalnych (20, 21).
Podobną obserwację dokonali na myszach Holland i współpracownicy, którzy wykazali, że myszy, którym podano olej smalcowy, miały wyższy poziom IL-6 i TNF-α w osoczu i wykazano, że efekt ten jest zależny od TLR4 (48).
Zbadano również wpływ spożycia wysokotłuszczowej diety przez rodziców - na układ odpornościowy potomstwa w modelach zwierzęcych.
Jedno z badań wykazało, że wysokotłuszczowa dieta rodziców może wpływać na zmiany w składzie mikroflory u potomstwa myszy i że zmiany te mogą zwiększać podatność na choroby zapalne, w tym alergię (49).
Co ważne, nie było różnic w stężeniu glukozy we krwi na czczo, ani w masie ciała pomiędzy młodymi dziećmi karmionymi dietą wysokotłuszczową i niskotłuszczową, co podkreśla, że obserwowanych efektów nie zakłócała cukrzyca ani otyłość [49].
Efekty międzypokoleniowe diety wysokotłuszczowej postulowali również Du i współpracownicy, którzy zaobserwowali przemijającą utratę włosów i nasilony stan zapalny skóry myszy urodzonych przez matki karmione dietą wysokotłuszczową.
Autorzy powiązali te zmiany ze zmienionym składem mleka matki, które było wzbogacone w długołańcuchowe i nasycone kwasy tłuszczowe (50).
Nasycone kwasy tłuszczowe
Dobrze opisano właściwości prozapalne nasyconych kwasów tłuszczowych in vitro.
Wykazano, że wyzwalają one wydzielanie mediatorów prozapalnych z różnych typów komórek, w tym makrofagów (51–54), adipocytów (55, 56), astrocytów (57) i komórek śródbłonka aorty (58).
Wykazano, że właściwości te zależą od wiązania nasyconych kwasów tłuszczowych z TLR4 (51, 52, 57, 59) lub TLR4 i TLR2 (60, 61).
Innym receptorem zdolnym do wiązania średnio - i długołańcuchowych kwasów tłuszczowych, w tym nasyconych kwasów tłuszczowych, jest receptor 40 sprzężony z białkiem G (GPR40) (62–64);
jednak wpływ interakcji nasyconych kwasów tłuszczowych-GPR40 na układ odpornościowy w stanie stacjonarnym - lub podczas zapalenia nie jest znany.
Skutki nasyconych kwasów tłuszczowych in vivo w modelach zwierzęcych są słabiej zbadane.
Kleinridders i współpracownicy wykazali, że karmienie myszy dietą wysokotłuszczową przez 13 tygodni, lub podawanie palmitynianu w ostrym wlewie do komory mózgowej może wywołać leptynę i insulinooporność, oraz że efekty te zależą od ekspresji pierwotnej odpowiedzi różnicowania szpiku 88 w ośrodkowym układzie nerwowym ( 65).
Podobnie Posey i wsp. wykazali, że wlew palmitynianu do komór mózgowych rekapituje skutki diety wysokotłuszczowej i wywołuje u szczurów zapalenie podwzgórza i insulinooporność (66).
Milański i wsp. Wykazali, że wlew kwasu stearynowego i arachidonowego indukuje prozapalną ekspresję genów w podwzgórzu (67).
Niedawno Beyaz i współpracownicy dokonali interesującej obserwacji, która dowiodła, że dieta wysokotłuszczowa sprzyjała samoodnowie komórek macierzystych jelit i że efekt ten został powtórzony poprzez ekspozycję ex vivo kultur organoidowych na kwas palmitynowy (68).
Dane te doprowadziły do postulatu, że nasycone kwasy tłuszczowe mogą odgrywać rolę w inicjacji guza.
Wreszcie, jedno badanie wykazało, że kwas palmitynowy może wywoływać zapalne uszkodzenie kardiomiocytów (69).
Autorzy wykazali, że oddziałuje bezpośrednio z antygenem limfocytów 96 (znanym jako białko adaptorowe MD2) i aktywuje sygnalizację TLR4.
Co ważne, zwierzęta z niedoborem MD2 były chronione przed uszkodzeniem mięśnia sercowego wywołanym kwasem palmitynowym (69).
Istnieje niewiele danych dotyczących wpływu nasyconych kwasów tłuszczowych in vivo na choroby płuc, z wykorzystaniem modeli zwierzęcych.
Podobnie brakuje badań epidemiologicznych dotyczących związku nasyconych kwasów tłuszczowych z dysfunkcją płuc.
Potrzebne są dalsze badania, aby ustalić udział nasyconych kwasów tłuszczowych w różnych stanach zapalnych, w tym w chorobach płuc, oraz w celu rozszyfrowania szlaków molekularnych, które one angażują.
Może to doprowadzić do opracowania nowych celów terapeutycznych, lub interwencji dietetycznych, które mogą złagodzić choroby zapalne.
Wielonienasycone kwasy tłuszczowe
Innym składnikiem tłuszczów w diecie są wielonienasycone kwasy tłuszczowe, które można dalej podzielić na kwasy tłuszczowe omega-3 i omega-6.
W diecie zachodniej spożycie kwasów tłuszczowych omega-6 jest podwyższone, podczas gdy omega-3 jest zmniejszone (1).
Badania epidemiologiczne od dawna sugerują korzystną rolę zmniejszonego stosunku omega-6 / omega-3 w różnych chorobach zapalnych.
Przydatne narzędzie do badania tego w kontrolowanych warunkach zostało wprowadzone przez Kanga i współpracowników, którzy stworzyli transgeniczne myszy z tłuszczem 1, u których desaturaza kwasów tłuszczowych n-3 przekształca omega-6 w kwasy tłuszczowe omega-3 (70).
Na tych myszach wykazano właściwości przeciwzapalne obniżonego stosunku omega-6 / omega-3 w różnych modelach, w tym w zapaleniu okrężnicy (71), zapaleniu wątroby (72), retinopatii (73) i padaczce (74), a także w modelach choroby płuc, takie jak
ostre uszkodzenie płuc (75) i
alergiczne zapalenie dróg oddechowych (76).
W modelu zapalenia jelita grubego poprawa wyniku choroby była związana z indukcją rezolwin, a także zmniejszeniem aktywności czynnika jądrowego κ B i regulacją w dół TNF-α, indukowanej syntazy tlenku azotu i ekspresji IL-1β (71) .
W modelu zapalenia wątroby korelował on ze zmniejszoną ekspresją genów TNF-α, IL-1β, IFN-γ i IL-6 w wątrobie (72).
W retinopatii myszy z tłuszczem 1 wykazywały zmniejszoną ekspresję TNF-α (73).
W modelu uszkodzenia płuc korzystna rola zwiększonego stosunku omega-3 / omega-6 była związana z obniżeniem poziomu białka-2 zapalenia makrofagów i tromboksanu B2 (77).
Wreszcie, w alergicznym zapaleniu dróg oddechowych efekt ten był związany ze zwiększonymi poziomami protektyny D1 i wydzielaniem E1 oraz ze zmniejszonymi poziomami cytokin prozapalnych (IL-1α, IL-2, IL-5, IL-9, IL-13, G- CSF [czynnik stymulujący tworzenie kolonii granulocytów], KC [chemoatraktant keratynocytów] i RANTES [regulowane po aktywacji, ekspresji i wydzielaniu prawidłowych komórek T]) (76).
Konsekwentnie, niektóre interwencje dietetyczne z użyciem kwasów tłuszczowych omega-3, ale nie omega-6, doprowadziły do podobnych obserwacji w różnych zwierzęcych modelach chorób, takich jak zapalenie okrężnicy (78–80), zapalenie układu nerwowego (81), insulinooporność (82) lub astma atopowa (83, 84).
Należy jednak zaznaczyć, że nie wszystkie kwasy tłuszczowe omega-6 mają podobne właściwości przeciwzapalne.
Na przykład opisano, że kwas γ-linolenowy ma właściwości przeciwzapalne w różnych stanach zapalnych.
Szczegółowy opis właściwości kwasu γ-linolenowego wykracza poza zakres tego przeglądu i został omówiony w innym miejscu (85–87).
Jednonienasycone kwasy tłuszczowe
Inną klasą nienasyconych kwasów tłuszczowych są jednonienasycone kwasy tłuszczowe, w tym kwasy tłuszczowe omega-7 i omega-9.
Kwas palmitooleinowy należący do kwasów tłuszczowych omega-7 został zidentyfikowany jako pochodzący z tkanki tłuszczowej hormon lipidowy stymulujący działanie insuliny w mięśniach i hamujący hepatosteozę (88).
Jego właściwości przeciwzapalne in vitro wykazali Macrae i współpracownicy, którzy wykazali, że hamuje on sygnalizację prozapalną wzmocnioną kwasem palmitynowym (89).
In vivo, jego korzystne działanie podkreślono na mysim modelu niealkoholowej stłuszczeniowej choroby wątroby (90).
Wreszcie Kanwar i współpracownicy zaobserwowali, że tłuszcz mleka wzbogacony w sprzężony kwas linolowy (należący do kwasów tłuszczowych omega-3) i kwas wakcenowy (należący do kwasów tłuszczowych omega-7) hamował alergiczne zapalenie dróg oddechowych w mysim modelu astmy (91) .
Co ciekawe, karmienie myszy sprzężonym kwasem linolowym lub samym kwasem wakcenowym nie było skuteczne w zapewnieniu tej ochrony, ale ich połączenie podsumowało wpływ tłuszczu mlecznego (91).
Z wyjątkiem tego ostatniego badania nie ma danych dotyczących roli kwasów tłuszczowych omega-7 w zwierzęcych modelach chorób płuc.
Brakuje również badań epidemiologicznych dotyczących związku jednonienasyconych kwasów tłuszczowych z podatnością na choroby płuc.
Badania in vitro dotyczące kwasów tłuszczowych omega-9 sugerują, że mają one właściwości przeciwzapalne.
Wykazano, że kwas oleinowy odwraca indukowaną kwasem palmitynowym insulinooporność i stan zapalny komórek mięśniowych (92).
Wykazano również, że hamuje wiązanie cytotoksycznych limfocytów T z głównymi celami klasy I zgodności tkankowej (93).
Dane te zostały poparte badaniami in vivo na modelach zwierzęcych choroby Alzheimera (94), cukrzycy typu 2 (95) i posocznicy (96), w których wykazano, że kwas oleinowy ma właściwości przeciwzapalne i zmniejsza nasilenie badanych schorzeń.
Rola kwasów tłuszczowych omega-9 podczas zapalenia płuc nie jest znana.
Brakuje kontrolowanych badań wykorzystujących modele zwierzęce, a badania epidemiologiczne są nieliczne.
Na podstawie tych badań jedno badanie wykazało brak jakiegokolwiek związku między kwasami tłuszczowymi omega-9 a astmą (97), podczas gdy inne wykazało dodatnią korelację dotyczącą tej choroby (98).
Oczywiście potrzeba więcej badań, aby wyjaśnić wpływ kwasów tłuszczowych omega-9 in vivo.
SCFA
(SCFA – nasycone kwasy tłuszczowe o działaniu prozdrowotnym )
Chociaż wśród SCFA można znaleźć w niektórych produktach spożywczych, takich jak masło, niektóre sery i mleko krowie, są to głównie produkty fermentacji bakteryjnej złożonych polisacharydów znajdujących się w błonniku pokarmowym.
Jednak ich rola w kontekście diety wysokotłuszczowej i krzyżowej reakcji odpornościowej może być istotna, ponieważ dieta zachodnia charakteryzuje się zmniejszoną zawartością błonnika pokarmowego (1), a spożycie diety wysokotłuszczowej może skutkować jeszcze niższym poziomem krążenia SCFA (18).
Dobrze udokumentowano, że SCFA wywierają właściwości przeciwzapalne in vitro (99–103).
Ponadto wykazano, że karmienie dietą bogatą w błonnik i suplementacja SCFA hamuje stan zapalny w zwierzęcych modelach chorób, w tym zapalenia okrężnicy (46, 77, 104, 105), alergii na orzeszki ziemne (47), a także alergicznego zapalenia dróg oddechowych (44, 45 ).
Dokładne mechanizmy działania SCFA są zróżnicowane, ponieważ wykazano, że sprzyjają one różnicowaniu regulacyjnych limfocytów T pomocniczych (77, 105-107), osłabiają zdolność komórek dendrytycznych do pobudzania odpowiedzi efektorowych komórek T (44) oraz wykazano, że wyzwalają aktywację inflamasomu (104).
Zwiększony poziom krótkołańcuchowych kwasów tłuszczowych podczas żywienia dietą wysokobłonnikową może być związany nie tylko z bezpośrednim trawieniem źródła składników odżywczych, ale także ze zmianami w składzie mikroflory obserwowanymi po długotrwałym karmieniu dietą.
My i inni wykazaliśmy, że myszy karmione dietą bogatą w błonnik miały podwyższony stosunek Bacteroidetes do Firmicutes w jelitach (44, 45) i płucach (44).
Warto zauważyć, że typ Bacteroidetes jest znany z tego, że jest silnym producentem SCFA (108).
Zmiany mikrobioty wywołane karmieniem dietą bogatą w błonnik mogą również przyczyniać się do obserwowanych efektów przeciwzapalnych niezależnie od krótkołańcuchowych kwasów tłuszczowych.
Aby zbadać tę kwestię, Tan i współpracownicy przeprowadzili eksperymenty rekolonizacji, w których myszom wolnym od zarazków przeszczepiano odchody myszy karmionych dietą bogatą - lub ubogą w błonnik (określaną jako mikroflora bogata w błonnik, lub myszy z mikrobiomem o niskiej zawartości błonnika), odpowiednio.
Co ciekawe, zwierzęta o wysokiej zawartości błonnika, ale nie o niskiej zawartości błonnika, były chronione przed alergią na orzeszki ziemne, chociaż obie grupy miały porównywalne poziomy krótkołańcuchowych kwasów tłuszczowych, co wskazuje, że te metabolity nie miały korzystnego wpływu.
Podsumowując, najprawdopodobniej przeciwzapalne właściwości żywienia dietą bogatą w błonnik wynikają z połączenia kilku czynników, w tym zwiększonego poziomu krążących krótkołańcuchowych kwasów tłuszczowych (pochodzących z fermentacji błonnika pokarmowego i dodatkowo wzmocnionych przez zmiany w składzie mikroflory na korzyść produktów wytwarzających SCFA) i zmiany w składzie mikroflory jelitowej / płucnej niezależnie od ich zdolności do wytwarzania SCFA.
Potrzebne są dalsze badania, aby zidentyfikować pożyteczne bakterie indukowane dietą bogatą w błonnik na poziomie gatunków i szczepów, oraz zdefiniować ich przeciwzapalne metabolity oprócz krótkołańcuchowych kwasów tłuszczowych.
Podsumowując, dowody z badań in vitro i in vivo na modelach zwierzęcych wskazują, że kwasy tłuszczowe mogą bezpośrednio modulować odpowiedzi immunologiczne i wpływać na podatność na choroby.
Ogólnie uważa się, że nasycone i wielonienasycone kwasy tłuszczowe omega-6 mają działanie prozapalne, podczas gdy wielonienasycone kwasy omega-3, jednonienasycone i krótkołańcuchowe kwasy tłuszczowe działają przeciwzapalnie.
Pomimo tych spostrzeżeń, fizjologiczny udział szlaków zaangażowanych przez te kwasy tłuszczowe w homeostazę i choroby zapalne jest niejasny.
Nie ustalono również ich znaczenia w utrzymaniu niskiego stopnia aktywacji układu odpornościowego w otyłości.
Potrzebne są dalsze badania, aby rzucić światło na te kwestie.
Ponadto dalsze odkrywanie szlaków molekularnych zaangażowanych przez różne kwasy tłuszczowe będzie ważne dla wyboru celów terapeutycznych, które mogą złagodzić stan zapalny.
Może to doprowadzić do zaprojektowania nowych, skuteczniejszych terapii, lub interwencji dietetycznych przeciwko różnym stanom zapalnym.
Poważne zmiany nawyków żywieniowych w krajach uprzemysłowionych w ostatnich dziesięcioleciach zbiegły się ze wzrostem występowania nadwrażliwości i autoimmunizacji.
Nadal jednak nie jest jasne, czy istnieje związek przyczynowy między tymi dwoma obserwacjami, ponieważ w tym samym okresie nastąpiły dodatkowe zmiany stylu życia, takie jak zwiększona czystość i zmniejszony kontakt z naszym środowiskiem naturalnym (w dużej mierze objęte „hipotezą higieniczną” i jej niedawnym pochodne).
Mimo to podsumowaliśmy istniejące dowody na to, że zmiany w diecie mają głęboki wpływ na nasz układ odpornościowy i podatność na choroby.
Efekty te można osiągnąć poprzez rozwój otyłości, zmiany mikrobioty wywołane dietą, lub bezpośrednie właściwości immunomodulujące składników odżywczych.
Te spostrzeżenia otwierają nowe możliwości dla przyszłych badań i rozwoju.
W szczególności istotne jest zidentyfikowanie pożytecznych i patogennych gatunków bakterii indukowanych przez określone składniki diety oraz wybranie metabolitów o potencjalnym działaniu immunomodulującym.
Ponadto badanie cech tych bakterii, w tym optymalnych warunków wzrostu i przetrwania w ich niszy ekologicznej, dostarczy nam nowych informacji na temat sposobów manipulowania nimi.
Wreszcie, ich charakterystyka molekularna i badania przesiewowe pod kątem unikalnych antygenów mogą stworzyć nowe narzędzia do farmakologicznego ukierunkowania na nie.
Odpowiedzi na te pytania będą ważne dla dalszego zdefiniowania wpływu „hipotezy dietetycznej” i połączenia go z innymi postulatami, takimi jak „hipoteza higieny”.
Bibliografia:
1 .Cordain L, Eaton SB, Sebastian A, Mann N, Lindeberg S, Watkins BA, O’Keefe JH, Brand-Miller J. Origins and evolution of the Western diet: health implications for the 21st century. Am J Clin Nutr 2005;81:341–354. Crossref, Medline, Google Scholar
2 .Eder W, Ege MJ, von Mutius E. The asthma epidemic. N Engl J Med 2006;355:2226–2235. Crossref, Medline, Google Scholar
3 .Bach JF. The effect of infections on susceptibility to autoimmune and allergic diseases. N Engl J Med 2002;347:911–920. Crossref, Medline, Google Scholar
4 .Hotamisligil GS. Inflammation and metabolic disorders. Nature 2006;444:860–867. Crossref, Medline, Google Scholar
5 .Alipour A, Elte JW, van Zaanen HC, Rietveld AP, Cabezas MC. Postprandial inflammation and endothelial dysfuction. Biochem Soc Trans 2007;35:466–469. Crossref, Medline, Google Scholar
6 .Kosteli A, Sugaru E, Haemmerle G, Martin JF, Lei J, Zechner R, Ferrante AW Jr. Weight loss and lipolysis promote a dynamic immune response in murine adipose tissue. J Clin Invest 2010;120:3466–3479. Crossref, Medline, Google Scholar
7 .Blackburn P, Després JP, Lamarche B, Tremblay A, Bergeron J, Lemieux I, Couillard C. Postprandial variations of plasma inflammatory markers in abdominally obese men. Obesity (Silver Spring) 2006;14:1747–1754. Crossref, Medline, Google Scholar
8 .Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease. Nature 2007;448:427–434. Crossref, Medline, Google Scholar
9 .Tilg H, Kaser A. Gut microbiome, obesity, and metabolic dysfunction. J Clin Invest 2011;121:2126–2132. Crossref, Medline, Google Scholar
10 .Larsen N, Vogensen FK, van den Berg FW, Nielsen DS, Andreasen AS, Pedersen BK, Al-Soud WA, Sørensen SJ, Hansen LH, Jakobsen M. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults. PLoS One 2010;5:e9085. Crossref, Medline, Google Scholar
11 .Clemente JC, Ursell LK, Parfrey LW, Knight R. The impact of the gut microbiota on human health: an integrative view. Cell 2012;148:1258–1270. Crossref, Medline, Google Scholar
12 .Turnbaugh PJ, Bäckhed F, Fulton L, Gordon JI. Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome. Cell Host Microbe 2008;3:213–223. Crossref, Medline, Google Scholar
13 .Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM, Delzenne NM, Burcelin R. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet–induced obesity and diabetes in mice. Diabetes 2008;57:1470–1481. Crossref, Medline, Google Scholar
14 .Cani PD, Possemiers S, Van de Wiele T, Guiot Y, Everard A, Rottier O, Geurts L, Naslain D, Neyrinck A, Lambert DM, et al. Changes in gut microbiota control inflammation in obese mice through a mechanism involving GLP-2–driven improvement of gut permeability. Gut 2009;58:1091–1103. Crossref, Medline, Google Scholar
15 .Caesar R, Tremaroli V, Kovatcheva-Datchary P, Cani PD, Bäckhed F. Crosstalk between gut microbiota and dietary lipids aggravates WAT inflammation through TLR signaling. Cell Metab 2015;22:658–668. Crossref, Medline, Google Scholar
16 .Amar J, Chabo C, Waget A, Klopp P, Vachoux C, Bermúdez-Humarán LG, Smirnova N, Bergé M, Sulpice T, Lahtinen S, et al. Intestinal mucosal adherence and translocation of commensal bacteria at the early onset of type 2 diabetes: molecular mechanisms and probiotic treatment. EMBO Mol Med 2011;3:559–572. Crossref, Medline, Google Scholar
17 .Jin C, Flavell RA. Innate sensors of pathogen and stress: linking inflammation to obesity. J Allergy Clin Immunol 2013;132:287–294. Crossref, Medline, Google Scholar
18 .Jakobsdottir G, Xu J, Molin G, Ahrné S, Nyman M. High-fat diet reduces the formation of butyrate, but increases succinate, inflammation, liver fat and cholesterol in rats, while dietary fibre counteracts these effects. PLoS One 2013;8:e80476. Crossref, Medline, Google Scholar
19 .Nappo F, Esposito K, Cioffi M, Giugliano G, Molinari AM, Paolisso G, Marfella R, Giugliano D. Postprandial endothelial activation in healthy subjects and in type 2 diabetic patients: role of fat and carbohydrate meals. J Am Coll Cardiol 2002;39:1145–1150. Crossref, Medline, Google Scholar
20 .van Oostrom AJ, Sijmonsma TP, Verseyden C, Jansen EH, de Koning EJ, Rabelink TJ, Castro Cabezas M. Postprandial recruitment of neutrophils may contribute to endothelial dysfunction. J Lipid Res 2003;44:576–583. Crossref, Medline, Google Scholar
21 .Wood LG, Garg ML, Gibson PG. A high-fat challenge increases airway inflammation and impairs bronchodilator recovery in asthma. J Allergy Clin Immunol 2011;127:1133–1140. Crossref, Medline, Google Scholar
22 .Li Q, Baines KJ, Gibson PG, Wood LG. Changes in expression of genes regulating airway inflammation following a high-fat mixed meal in asthmatics. Nutrients 2016;8:8. Crossref, Google Scholar
23 .Trottier MD, Naaz A, Li Y, Fraker PJ. Enhancement of hematopoiesis and lymphopoiesis in diet-induced obese mice. Proc Natl Acad Sci USA 2012;109:7622–7629. Crossref, Medline, Google Scholar
24 .Balmer ML, Schürch CM, Saito Y, Geuking MB, Li H, Cuenca M, Kovtonyuk LV, McCoy KD, Hapfelmeier S, Ochsenbein AF, et al. Microbiota-derived compounds drive steady-state granulopoiesis via MyD88/TICAM signaling. J Immunol 2014;193:5273–5283. Crossref, Medline, Google Scholar
25 .Zhou Q, Leeman SE, Amar S. Signaling mechanisms involved in altered function of macrophages from diet-induced obese mice affect immune responses. Proc Natl Acad Sci USA 2009;106:10740–10745. Crossref, Medline, Google Scholar
26 .Kordonowy LL, Burg E, Lenox CC, Gauthier LM, Petty JM, Antkowiak M, Palvinskaya T, Ubags N, Rincón M, Dixon AE, et al. Obesity is associated with neutrophil dysfunction and attenuation of murine acute lung injury. Am J Respir Cell Mol Biol 2012;47:120–127. Abstract, Medline, Google Scholar
27 .Ubags ND, Burg E, Antkowiak M, Wallace AM, Dilli E, Bement J, Wargo MJ, Poynter ME, Wouters EF, Suratt BT. A comparative study of lung host defense in murine obesity models: insights into neutrophil function. Am J Respir Cell Mol Biol 2016;55:188–200. Abstract, Medline, Google Scholar
28 .Smith AG, Sheridan PA, Harp JB, Beck MA. Diet-induced obese mice have increased mortality and altered immune responses when infected with influenza virus. J Nutr 2007;137:1236–1243. Crossref, Medline, Google Scholar
29 .Easterbrook JD, Dunfee RL, Schwartzman LM, Jagger BW, Sandouk A, Kash JC, Memoli MJ, Taubenberger JK. Obese mice have increased morbidity and mortality compared to non-obese mice during infection with the 2009 pandemic H1N1 influenza virus. Influenza Other Respi Viruses 2011;5:418–425. Crossref, Medline, Google Scholar
30 .Milner JJ, Sheridan PA, Karlsson EA, Schultz-Cherry S, Shi Q, Beck MA. Diet-induced obese mice exhibit altered heterologous immunity during a secondary 2009 pandemic H1N1 infection. J Immunol 2013;191:2474–2485. Crossref, Medline, Google Scholar
31 .Sheridan PA, Paich HA, Handy J, Karlsson EA, Hudgens MG, Sammon AB, Holland LA, Weir S, Noah TL, Beck MA. Obesity is associated with impaired immune response to influenza vaccination in humans. Int J Obes 2012;36:1072–1077. Crossref, Google Scholar
32 .Smith AG, Sheridan PA, Tseng RJ, Sheridan JF, Beck MA. Selective impairment in dendritic cell function and altered antigen-specific CD8+ T-cell responses in diet-induced obese mice infected with influenza virus. Immunology 2009;126:268–279. Crossref, Medline, Google Scholar
33 .Karlsson EA, Sheridan PA, Beck MA. Diet-induced obesity impairs the T cell memory response to influenza virus infection. J Immunol 2010;184:3127–3133. Crossref, Medline, Google Scholar
34 .Mathews JA, Wurmbrand AP, Ribeiro L, Neto FL, Shore SA. Induction of IL-17A precedes development of airway hyperresponsiveness during diet-induced obesity and correlates with complement factor D. Front Immunol 2014;5:440. Crossref, Medline, Google Scholar
35 .Kim HY, Lee HJ, Chang YJ, Pichavant M, Shore SA, Fitzgerald KA, Iwakura Y, Israel E, Bolger K, Faul J, et al. Interleukin-17–producing innate lymphoid cells and the NLRP3 inflammasome facilitate obesity-associated airway hyperreactivity. Nat Med 2014;20:54–61. Crossref, Medline, Google Scholar
36 .Everaere L, Ait-Yahia S, Molendi-Coste O, Vorng H, Quemener S, LeVu P, Fleury S, Bouchaert E, Fan Y, Duez C, et al. Innate lymphoid cells contribute to allergic airway disease exacerbation by obesity. J Allergy Clin Immunol 2016;138:1309–1318.e11. Crossref, Medline, Google Scholar
37 .King DE, Mainous AG III, Lambourne CA. Trends in dietary fiber intake in the United States, 1999–2008. J Acad Nutr Diet 2012;112:642–648. Crossref, Medline, Google Scholar
38 .Sonnenburg ED, Sonnenburg JL. Starving our microbial self: the deleterious consequences of a diet deficient in microbiota-accessible carbohydrates. Cell Metab 2014;20:779–786. Crossref, Medline, Google Scholar
39 .Hanson C, Lyden E, Rennard S, Mannino DM, Rutten EP, Hopkins R, Young R. The relationship between dietary fiber intake and lung function in the National Health and Nutrition Examination Surveys. Ann Am Thorac Soc 2016;13:643–650. Abstract, Medline, Google Scholar
40 .Chuang SC, Norat T, Murphy N, Olsen A, Tjønneland A, Overvad K, Boutron-Ruault MC, Perquier F, Dartois L, Kaaks R, et al. Fiber intake and total and cause-specific mortality in the European Prospective Investigation into Cancer and Nutrition cohort. Am J Clin Nutr 2012;96:164–174. Crossref, Medline, Google Scholar
41 .Park Y, Subar AF, Hollenbeck A, Schatzkin A. Dietary fiber intake and mortality in the NIH–AARP Diet and Health Study. Arch Intern Med 2011;171:1061–1068. Crossref, Medline, Google Scholar
42 .Halnes I, Baines KJ, Berthon BS, MacDonald-Wicks LK, Gibson PG, Wood LG. Soluble fibre meal challenge reduces airway inflammation and expression of GPR43 and GPR41 in asthma. Nutrients 2017;9:1. Crossref, Google Scholar
43 .Desai MS, Seekatz AM, Koropatkin NM, Kamada N, Hickey CA, Wolter M, Pudlo NA, Kitamoto S, Terrapon N, Muller A, et al. A dietary fiber–deprived gut microbiota degrades the colonic mucus barrier and enhances pathogen susceptibility. Cell 2016;167:1339–1353.e21. Crossref, Medline, Google Scholar
44 .Trompette A, Gollwitzer ES, Yadava K, Sichelstiel AK, Sprenger N, Ngom-Bru C, Blanchard C, Junt T, Nicod LP, Harris NL, et al. Gut microbiota metabolism of dietary fiber influences allergic airway disease and hematopoiesis. Nat Med 2014;20:159–166. Crossref, Medline, Google Scholar
45 .Thorburn AN, McKenzie CI, Shen S, Stanley D, Macia L, Mason LJ, Roberts LK, Wong CH, Shim R, Robert R, et al. Evidence that asthma is a developmental origin disease influenced by maternal diet and bacterial metabolites. Nat Commun 2015;6:7320. Crossref, Medline, Google Scholar
46 .Maslowski KM, Vieira AT, Ng A, Kranich J, Sierro F, Yu D, Schilter HC, Rolph MS, Mackay F, Artis D, et al. Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43. Nature 2009;461:1282–1286. Crossref, Medline, Google Scholar
47 .Tan J, McKenzie C, Vuillermin PJ, Goverse G, Vinuesa CG, Mebius RE, Macia L, Mackay CR. Dietary fiber and bacterial SCFA enhance oral tolerance and protect against food allergy through diverse cellular pathways. Cell Reports 2016;15:2809–2824. Crossref, Medline, Google Scholar
48 .Holland WL, Bikman BT, Wang LP, Yuguang G, Sargent KM, Bulchand S, Knotts TA, Shui G, Clegg DJ, Wenk MR, et al. Lipid-induced insulin resistance mediated by the proinflammatory receptor TLR4 requires saturated fatty acid–induced ceramide biosynthesis in mice. J Clin Invest 2011;121:1858–1870. Crossref, Medline, Google Scholar
49 .Myles IA, Fontecilla NM, Janelsins BM, Vithayathil PJ, Segre JA, Datta SK. Parental dietary fat intake alters offspring microbiome and immunity. J Immunol 2013;191:3200–3209. Crossref, Medline, Google Scholar
50 .Du Y, Yang M, Lee S, Behrendt CL, Hooper LV, Saghatelian A, Wan Y. Maternal Western diet causes inflammatory milk and TLR2/4-dependent neonatal toxicity. Genes Dev 2012;26:1306–1311. Crossref, Medline, Google Scholar
51 .Lee JY, Sohn KH, Rhee SH, Hwang D. Saturated fatty acids, but not unsaturated fatty acids, induce the expression of cyclooxygenase-2 mediated through Toll-like receptor 4. J Biol Chem 2001;276:16683–16689. Crossref, Medline, Google Scholar
52 .Shi H, Kokoeva MV, Inouye K, Tzameli I, Yin H, Flier JS. TLR4 links innate immunity and fatty acid–induced insulin resistance. J Clin Invest 2006;116:3015–3025. Crossref, Medline, Google Scholar
53 .Laine PS, Schwartz EA, Wang Y, Zhang WY, Karnik SK, Musi N, Reaven PD. Palmitic acid induces IP-10 expression in human macrophages via NF-κB activation. Biochem Biophys Res Commun 2007;358:150–155. Crossref, Medline, Google Scholar
54 .Håversen L, Danielsson KN, Fogelstrand L, Wiklund O. Induction of proinflammatory cytokines by long-chain saturated fatty acids in human macrophages. Atherosclerosis 2009;202:382–393. Crossref, Medline, Google Scholar
55 .Ajuwon KM, Spurlock ME. Palmitate activates the NF-κB transcription factor and induces IL-6 and TNFα expression in 3T3-L1 adipocytes. J Nutr 2005;135:1841–1846. Crossref, Medline, Google Scholar
56 .Bradley RL, Fisher FF, Maratos-Flier E. Dietary fatty acids differentially regulate production of TNF-α and IL-10 by murine 3T3-L1 adipocytes. Obesity (Silver Spring) 2008;16:938–944. Crossref, Medline, Google Scholar
57 .Gupta S, Knight AG, Gupta S, Keller JN, Bruce-Keller AJ. Saturated long-chain fatty acids activate inflammatory signaling in astrocytes. J Neurochem 2012;120:1060–1071. Medline, Google Scholar
58 .Stentz FB, Kitabchi AE. Palmitic acid–induced activation of human T-lymphocytes and aortic endothelial cells with production of insulin receptors, reactive oxygen species, cytokines, and lipid peroxidation. Biochem Biophys Res Commun 2006;346:721–726. Crossref, Medline, Google Scholar
59 .Hwang D. Modulation of the expression of cyclooxygenase-2 by fatty acids mediated through Toll-like receptor 4–derived signaling pathways. FASEB J 2001;15:2556–2564. Crossref, Medline, Google Scholar
60 .Lee JY, Zhao L, Youn HS, Weatherill AR, Tapping R, Feng L, Lee WH, Fitzgerald KA, Hwang DH. Saturated fatty acid activates but polyunsaturated fatty acid inhibits Toll-like receptor 2 dimerized with Toll-like receptor 6 or 1. J Biol Chem 2004;279:16971–16979. Crossref, Medline, Google Scholar
61 .Nguyen MT, Favelyukis S, Nguyen AK, Reichart D, Scott PA, Jenn A, Liu-Bryan R, Glass CK, Neels JG, Olefsky JM. A subpopulation of macrophages infiltrates hypertrophic adipose tissue and is activated by free fatty acids via Toll-like receptors 2 and 4 and JNK-dependent pathways. J Biol Chem 2007;282:35279–35292. Crossref, Medline, Google Scholar
62 .Briscoe CP, Tadayyon M, Andrews JL, Benson WG, Chambers JK, Eilert MM, Ellis C, Elshourbagy NA, Goetz AS, Minnick DT, et al. The orphan G protein–coupled receptor GPR40 is activated by medium and long chain fatty acids. J Biol Chem 2003;278:11303–11311. Crossref, Medline, Google Scholar
63 .Itoh Y, Kawamata Y, Harada M, Kobayashi M, Fujii R, Fukusumi S, Ogi K, Hosoya M, Tanaka Y, Uejima H, et al. Free fatty acids regulate insulin secretion from pancreatic beta cells through GPR40. Nature 2003;422:173–176. Crossref, Medline, Google Scholar
64 .Kotarsky K, Nilsson NE, Flodgren E, Owman C, Olde B. A human cell surface receptor activated by free fatty acids and thiazolidinedione drugs. Biochem Biophys Res Commun 2003;301:406–410. Crossref, Medline, Google Scholar
65 .Kleinridders A, Schenten D, Könner AC, Belgardt BF, Mauer J, Okamura T, Wunderlich FT, Medzhitov R, Brüning JC. MyD88 signaling in the CNS is required for development of fatty acid–induced leptin resistance and diet-induced obesity. Cell Metab 2009;10:249–259. Crossref, Medline, Google Scholar
66 .Posey KA, Clegg DJ, Printz RL, Byun J, Morton GJ, Vivekanandan-Giri A, Pennathur S, Baskin DG, Heinecke JW, Woods SC, et al. Hypothalamic proinflammatory lipid accumulation, inflammation, and insulin resistance in rats fed a high-fat diet. Am J Physiol Endocrinol Metab 2009;296:E1003–E1012. Crossref, Medline, Google Scholar
67 .Milanski M, Degasperi G, Coope A, Morari J, Denis R, Cintra DE, Tsukumo DM, Anhe G, Amaral ME, Takahashi HK, et al. Saturated fatty acids produce an inflammatory response predominantly through the activation of TLR4 signaling in hypothalamus: implications for the pathogenesis of obesity. J Neurosci 2009;29:359–370. Crossref, Medline, Google Scholar
68 .Beyaz S, Mana MD, Roper J, Kedrin D, Saadatpour A, Hong SJ, Bauer-Rowe KE, Xifaras ME, Akkad A, Arias E, et al. High-fat diet enhances stemness and tumorigenicity of intestinal progenitors. Nature 2016;531:53–58. Crossref, Medline, Google Scholar
69 .Wang Y, Qian Y, Fang Q, Zhong P, Li W, Wang L, Fu W, Zhang Y, Xu Z, Li X, et al. Saturated palmitic acid induces myocardial inflammatory injuries through direct binding to TLR4 accessory protein MD2. Nat Commun 2017;8:13997. Crossref, Medline, Google Scholar
70 .Kang JX. Fat-1 transgenic mice: a new model for omega-3 research. Prostaglandins Leukot Essent Fatty Acids 2007;77:263–267. Crossref, Medline, Google Scholar
71 .Hudert CA, Weylandt KH, Lu Y, Wang J, Hong S, Dignass A, Serhan CN, Kang JX. Transgenic mice rich in endogenous omega-3 fatty acids are protected from colitis. Proc Natl Acad Sci USA 2006;103:11276–11281. Crossref, Medline, Google Scholar
72 .Schmöcker C, Weylandt KH, Kahlke L, Wang J, Lobeck H, Tiegs G, Berg T, Kang JX. Omega-3 fatty acids alleviate chemically induced acute hepatitis by suppression of cytokines. Hepatology 2007;45:864–869. Crossref, Medline, Google Scholar
73 .Connor KM, SanGiovanni JP, Lofqvist C, Aderman CM, Chen J, Higuchi A, Hong S, Pravda EA, Majchrzak S, Carper D, et al. Increased dietary intake of omega-3-polyunsaturated fatty acids reduces pathological retinal angiogenesis. Nat Med 2007;13:868–873. Crossref, Medline, Google Scholar
74 .DeGiorgio CM, Taha AY. Omega-3 fatty acids (ῳ-3 fatty acids) in epilepsy: animal models and human clinical trials. Expert Rev Neurother 2016;16:1141–1145. Crossref, Medline, Google Scholar
75 .Mayer K, Kiessling A, Ott J, Schaefer MB, Hecker M, Henneke I, Schulz R, Günther A, Wang J, Wu L, et al. Acute lung injury is reduced in fat-1 mice endogenously synthesizing n-3 fatty acids. Am J Respir Crit Care Med 2009;179:474–483. Abstract, Medline, Google Scholar
76 .Bilal S, Haworth O, Wu L, Weylandt KH, Levy BD, Kang JX. Fat-1 transgenic mice with elevated omega-3 fatty acids are protected from allergic airway responses. Biochim Biophys Acta 2011;1812:1164–1169. Crossref, Medline, Google Scholar
77 .Smith PM, Howitt MR, Panikov N, Michaud M, Gallini CA, Bohlooly-Y M, Glickman JN, Garrett WS. The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis. Science 2013;341:569–573. Crossref, Medline, Google Scholar
78 .Vilaseca J, Salas A, Guarner F, Rodríguez R, Martínez M, Malagelada JR. Dietary fish oil reduces progression of chronic inflammatory lesions in a rat model of granulomatous colitis. Gut 1990;31:539–544. Crossref, Medline, Google Scholar
79 .Empey LR, Jewell LD, Garg ML, Thomson AB, Clandinin MT, Fedorak RN. Fish oil–enriched diet is mucosal protective against acetic acid–induced colitis in rats. Can J Physiol Pharmacol 1991;69:480–487. Crossref, Medline, Google Scholar
80 .Andoh A, Tsujikawa T, Ishizuka I, Araki Y, Sasaki M, Koyama S, Fujiyama Y. n-3 fatty acid–rich diet prevents early response of interleukin-6 elevation in trinitrobenzene sulfonic acid–induced enteritis. Int J Mol Med 2003;12:721–725. Medline, Google Scholar
81 .Orr SK, Trépanier MO, Bazinet RP. n-3 polyunsaturated fatty acids in animal models with neuroinflammation. Prostaglandins Leukot Essent Fatty Acids 2013;88:97–103. Crossref, Medline, Google Scholar
82 .Lalia AZ, Lanza IR. Insulin-sensitizing effects of omega-3 fatty acids: lost in translation? Nutrients 2016;8:6. Crossref, Google Scholar
83 .Yokoyama A, Hamazaki T, Ohshita A, Kohno N, Sakai K, Zhao GD, Katayama H, Hiwada K. Effect of aerosolized docosahexaenoic acid in a mouse model of atopic asthma. Int Arch Allergy Immunol 2000;123:327–332. Crossref, Medline, Google Scholar
84 .Morin C, Fortin S, Cantin AM, Rousseau E. Docosahexaenoic acid derivative prevents inflammation and hyperreactivity in lung: implication of PKC-potentiated inhibitory protein for heterotrimeric myosin light chain phosphatase of 17 kD in asthma. Am J Respir Cell Mol Biol 2011;45:366–375. Abstract, Medline, Google Scholar
85 .Sergeant S, Rahbar E, Chilton FH. Gamma-linolenic acid, dihommo-gamma linolenic, eicosanoids and inflammatory processes. Eur J Pharmacol 2016;785:77–86. Crossref, Medline, Google Scholar
86 .Kapoor R, Huang YS. Gamma linolenic acid: an antiinflammatory omega-6 fatty acid. Curr Pharm Biotechnol 2006;7:531–534. Crossref, Medline, Google Scholar
87 .Fan YY, Chapkin RS. Importance of dietary γ-linolenic acid in human health and nutrition. J Nutr 1998;128:1411–1414. Crossref, Medline, Google Scholar
88 .Cao H, Gerhold K, Mayers JR, Wiest MM, Watkins SM, Hotamisligil GS. Identification of a lipokine, a lipid hormone linking adipose tissue to systemic metabolism. Cell 2008;134:933–944. Crossref, Medline, Google Scholar
89 .Macrae K, Stretton C, Lipina C, Blachnio-Zabielska A, Baranowski M, Gorski J, Marley A, Hundal HS. Defining the role of DAG, mitochondrial function, and lipid deposition in palmitate-induced proinflammatory signaling and its counter-modulation by palmitoleate. J Lipid Res 2013;54:2366–2378. Crossref, Medline, Google Scholar
90 .Guo X, Li H, Xu H, Halim V, Zhang W, Wang H, Ong KT, Woo SL, Walzem RL, Mashek DG, et al. Palmitoleate induces hepatic steatosis but suppresses liver inflammatory response in mice. PLoS One 2012;7:e39286. Crossref, Medline, Google Scholar
91 .Kanwar RK, Macgibbon AK, Black PN, Kanwar JR, Rowan A, Vale M, Krissansen GW. Bovine milk fat enriched in conjugated linoleic and vaccenic acids attenuates allergic airway disease in mice. Clin Exp Allergy 2008;38:208–218. Medline, Google Scholar
92 .Coll T, Eyre E, Rodríguez-Calvo R, Palomer X, Sánchez RM, Merlos M, Laguna JC, Vázquez-Carrera M. Oleate reverses palmitate-induced insulin resistance and inflammation in skeletal muscle cells. J Biol Chem 2008;283:11107–11116. Crossref, Medline, Google Scholar
93 .Anel A, Mescher MF, Kleinfeld AM. Activated adhesion of CTL to MHC class I but not to fibronectin is inhibited by cis unsaturated fatty acids and phenylarsine oxide. J Immunol 1995;155:1039–1046. Medline, Google Scholar
94 .Amtul Z, Westaway D, Cechetto DF, Rozmahel RF. Oleic acid ameliorates amyloidosis in cellular and mouse models of Alzheimer’s disease. Brain Pathol 2011;21:321–329. Crossref, Medline, Google Scholar
95 .Oliveira V, Marinho R, Vitorino D, Santos GA, Moraes JC, Dragano N, Sartori-Cintra A, Pereira L, Catharino RR, da Silva AS, et al. Diets containing α-linolenic (ω3) or oleic (ω9) fatty acids rescues obese mice from insulin resistance. Endocrinology 2015;156:4033–4046. Crossref, Medline, Google Scholar
96 .Gonçalves-de-Albuquerque CF, Medeiros-de-Moraes IM, Oliveira FM, Burth P, Bozza PT, Castro Faria MV, Silva AR, Castro-Faria-Neto HC. Omega-9 oleic acid induces fatty acid oxidation and decreases organ dysfunction and mortality in experimental sepsis. PLoS One 2016;11:e0153607. Crossref, Medline, Google Scholar
97 .de Luis DA, Armentia A, Aller R, Asensio A, Sedano E, Izaola O, Cuellar L. Dietary intake in patients with asthma: a case control study. Nutrition 2005;21:320–324. Crossref, Medline, Google Scholar
98 .Nagel G, Linseisen J. Dietary intake of fatty acids, antioxidants and selected food groups and asthma in adults. Eur J Clin Nutr 2005;59:8–15. Crossref, Medline, Google Scholar
99 .Siavoshian S, Blottière HM, Bentouimou N, Cherbut C, Galmiche JP. Butyrate enhances major histocompatibility complex class I, HLA-DR and ICAM-1 antigen expression on differentiated human intestinal epithelial cells. Eur J Clin Invest 1996;26:803–810. Crossref, Medline, Google Scholar
100 .Segain JP, Raingeard de la Blétière D, Bourreille A, Leray V, Gervois N, Rosales C, Ferrier L, Bonnet C, Blottière HM, Galmiche JP. Butyrate inhibits inflammatory responses through NFκB inhibition: implications for Crohn’s disease. Gut 2000;47:397–403. Crossref, Medline, Google Scholar
101 .Tedelind S, Westberg F, Kjerrulf M, Vidal A. Anti-inflammatory properties of the short-chain fatty acids acetate and propionate: a study with relevance to inflammatory bowel disease. World J Gastroenterol 2007;13:2826–2832. Crossref, Medline, Google Scholar
102 .Gilbert KM, Weigle WO. Th1 cell anergy and blockade in G1a phase of the cell cycle. J Immunol 1993;151:1245–1254. Medline, Google Scholar
103 .Böhmig GA, Krieger PM, Säemann MD, Wenhardt C, Pohanka E, Zlabinger GJ. n-Butyrate downregulates the stimulatory function of peripheral blood–derived antigen-presenting cells: a potential mechanism for modulating T-cell responses by short-chain fatty acids. Immunology 1997;92:234–243. Crossref, Medline, Google Scholar
104 .Macia L, Tan J, Vieira AT, Leach K, Stanley D, Luong S, Maruya M, Ian McKenzie C, Hijikata A, Wong C, et al. Metabolite-sensing receptors GPR43 and GPR109A facilitate dietary fibre-induced gut homeostasis through regulation of the inflammasome. Nat Commun 2015;6:6734. Crossref, Medline, Google Scholar
105 .Singh N, Gurav A, Sivaprakasam S, Brady E, Padia R, Shi H, Thangaraju M, Prasad PD, Manicassamy S, Munn DH, et al. Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis. Immunity 2014;40:128–139. Crossref, Medline, Google Scholar
106 .Arpaia N, Campbell C, Fan X, Dikiy S, van der Veeken J, deRoos P, Liu H, Cross JR, Pfeffer K, Coffer PJ, et al. Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation. Nature 2013;504:451–455. Crossref, Medline, Google Scholar
107 .Furusawa Y, Obata Y, Fukuda S, Endo TA, Nakato G, Takahashi D, Nakanishi Y, Uetake C, Kato K, Kato T, et al. Commensal microbe–derived butyrate induces the differentiation of colonic regulatory T cells. Nature 2013;504:446–450. Crossref, Medline, Google Scholar
108 .De Filippo C, Cavalieri D, Di Paola M, Ramazzotti M, Poullet JB, Massart S, Collini S, Pieraccini G, Lionetti P. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Natl Acad Sci USA 2010;107:14691–14696. Crossref, Medline, Google Scholar
Źródło:
https://www.atsjournals.org/doi/10.1513/AnnalsATS.201703-255AW